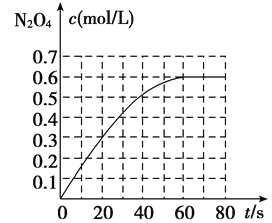
题目内容
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_____________________________________________,所得溶液中c(H+)- c(OH-)=___________________________(填写表达式)

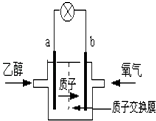
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如右图所示(电极材料为石墨)。
① 图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②SO32-放电的电极反应式为______________________________。
【答案】 酸 c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-) c(HSO3-) + 2c(SO32-) -c(NH4+) 或 c(SO32-) + c(NH3·H2O) - c(H2SO3) 负 硫酸 SO32--2e- + H2O = SO42-+ 2H+
【解析】(1)若将等物质的量的SO2与NH3溶于水充分反应,恰好生成NH4HSO3,溶液中存在NH4+、HSO3-的电离及HSO3-的水解,且HSO3-的电离大于HSO3-的水解,所得溶液呈酸性,c(OH-)<c(H+);该溶液中各离子浓度由大到小的顺序为 c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-) ;电解质溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-)得到:c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+);
(2)图中可知,钠离子移向a极,亚硫酸根离子移向b极,所以b极为阳极,应该接电源的正极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4;
(3)亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO32--2e-+H2O=SO42-+2H+。

【题目】研究小组用如图装置制取Cl2 , 证明产生的气体中含有HCl. 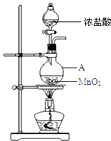
(1)仪器A的名称为;A中反应的离子方程式为;
(2)甲同学将A中产生的气体通入如表溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
(4)已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04molL﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10molL﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL﹣1 AgNO3溶液的体积应大于mL(用含V的代数式表示).