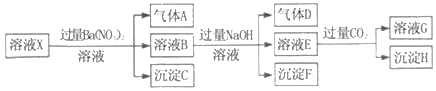
��Ŀ����
����Ŀ���о�С������ͼװ����ȡCl2 �� ֤�������������к���HCl�� 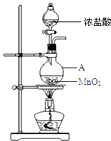
��1������A������Ϊ��A�з�Ӧ�����ӷ���ʽΪ��
��2����ͬѧ��A�в���������ͨ�������Һ��
ʵ����� | �Լ� | ���� |
a | ��ɫʯ����Һ | |
b | AgNO3��Һ | ���ְ�ɫ���� |
��ʵ��a�е�����Ϊ��
�ڲ���֤�������������к���HCl��ʵ����������ĸ��ţ���
��3����֪��HCl����ͨ�뱥��ʳ��ˮ���а�ɫ������������ͬѧ��A�в���������ͨ�뱥��ʳ��ˮ�У��а�ɫ��������������ʵ�鲻��֤�������к���HCl����ϻ�ѧ���������ԭ����
��4����֪��2S2O32��+I2�TS4O62��+2I�� �� ��ͬѧ��A�в���������ͨ������ˮ�У��õ���ҺX����������ʵ��֤�������к���HCl��
I���ⶨX���ܽ��Cl2 �� ȡ25.00mL��ҺX���������KI��Һ��Ȼ����0.04molL��1 Na2S2O3��Һ�ζ�����
��I2 �� ��ζ��յ�ʱ����Na2S2O3��ҺV mL��
�ⶨX��ClԪ����������ȡ25.00mL��ҺX��ѡ���ʵ��Ļ�ԭ�����ܽ��Cl2ȫ����ԭΪCl�� �� ����0.10molL��1 AgNO3��Һ�ζ�������Һ�е�Cl�� ��
��X�е�HClO����Ӱ��I�IJⶨ�����ԭ������
����I������ʵ�����ݿ�֤��A�в����������к���HCl�����������0.10molL��1 AgNO3��Һ�����Ӧ����mL���ú�V�Ĵ���ʽ��ʾ����
���𰸡�
��1��Բ����ƿ��MnO2+4H++2Cl�� ![]() ?Cl2��+2H2O+Mn2+
?Cl2��+2H2O+Mn2+
��2���ȱ�����ɫ��a��b
��3��Cl2+H2O?HCl+HClO��Cl2����ˮ��ʹ����Һ�е�c��Cl��������Ҳ����������
��4������1mol HClO������1mol Cl2 �� HClOҲ�������ԣ�1mol HClO��1mol Cl2���ܽ�2mol KI������I2��0.4V
���������⣺��1.������A������ΪԲ����ƿ����Һ©���е�Ũ�����Բ����ƿ�еĶ������̷�����Ӧ�����������Ȼ��̡���ˮ�����ӷ���ʽΪ��MnO2+4H++2Cl�� ![]() Cl2��+2H2O+Mn2+ �� ���Դ��ǣ�Բ����ƿ�� MnO2+4H++2Cl��
Cl2��+2H2O+Mn2+ �� ���Դ��ǣ�Բ����ƿ�� MnO2+4H++2Cl�� ![]() Cl2��+2H2O+Mn2+��
Cl2��+2H2O+Mn2+��
��2.����������ˮ��Ӧ��������ʹ����ᣬ���������������ӣ���Һ�����ԣ�������ɫ��ʯ���Լ��Ժ�ɫ�����������Ư���ԣ��DZ�����Һ��ɫ����������Ϊ���ȱ�����ɫ�����Դ��ǣ��ȱ�����ɫ����������ˮ��Ӧ��������ʹ����ᣬ��������ܹ����������Ӻ������ӣ���Һ�����ԣ����������������Ӳ�����ɫ����������a��b������֤�������������к���HCl�����Դ��ǣ�ab��
��3.��������ˮ��Ӧ��������ʹ����ᣬ����ʽΪ��Cl2+H2OHCl+HClO��Cl2����ˮ��ʹ����Һ�е�c��Cl���������������Ȼ��Ƶ��ܽ⣬��Ҳ�о������������Դ��ǣ�Cl2+H2OHCl+HClO��Cl2����ˮ��ʹ����Һ�е�c��Cl��������Ҳ���������壻
��4.����Cl2+H2OHCl+HClO������1 mol HClO������1 mol Cl2 �� HClOҲ�������ԣ�1 mol HClO��1 mol Cl2���ܽ�2 mol KI������I2��
���Դ��ǣ�����1 mol HClO������1 mol Cl2 �� HClOҲ�������ԣ�1 mol HClO��1 mol Cl2���ܽ�2 mol KI������I2��
�ڸ��ݢ���и����Ĺ�ϵ��֪��
2S2O32�� | �� | 2I�� | �� | Cl2 | �� | 2Cl�� | �� | 2Ag+ |
2 | 2 | |||||||
0.04molL��1��V | 0.10molL��1��V��AgNO3�� |
��ã�V��AgNO3��=0.4Vml��
A�в��������������Ǻ���HCl��HClҲ������������Ӧ���������ĵ���������Һ�����Ӧ����0.4Vml��
���Դ��ǣ�0.4V��
�����㾫�������ڱ��⿼��������Ļ�ѧ���ʺ�������ʵ�����Ʒ�����Ҫ�˽������Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ��ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O���ܵó���ȷ�𰸣�

����Ŀ��������ѧ֪ʶ��ա�
��1�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ��ʾ�� 
���������������� ��
�������ĵ缫��Ӧʽ�� ��
��2���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO��g��+2H2��g��CH3OH��g����H1
��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H2
��CO2��g��+H2��g��CO��g��+H2O��g����H3
��֪��Ӧ������صĻ�ѧ���������������
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/��KJmol��1�� | 436 | 343 | 1075 | 465 | 413 |
�ɴ˼����H1=kJmol��1 �� ��֪��H2=��58kJmol��1 �� ���H3=kJmol��1 ��