题目内容
【题目】工业炼铁过程中涉及到的主要反应有:
i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
回答下列问题:
(1)反应iv_________(填“能”或“不能”)在任何温度下自发进行。
(2)△H3=_________kJ/mol。
(3)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应iii,5min时达到平衡,平衡时测得混合气体中CO2的体积分数为80%。
①0~5min内反应的平均速率v(CO2)=_________molL-lmin-l。
②该温度下反应的平衡常数为_________。
③若将平衡后的混合气体通入1L3.6mol/L的NaOH溶液,恰好完全反应,反应的离子方程式为_________,所得溶液中离子浓度由大到小的顺序是_________
④下列选项中能够说明该反应已经达到平衡状态的是_________(填序号)。
a.Fe2O3的物质的量不再变化
b.体系的压强保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO和生成CO2的物质的量相等
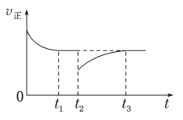
(4)一定条件下进行反应iii,正向反应速率与时间的关系如图所示,t2时刻改变了一个外界条件,可能是_________。
 .
.
【答案】不能 -28 0.048 64 2CO2+3OHˉ=CO![]() +HCO
+HCO![]() +H2O c(Na+)>c(HCO
+H2O c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ) > c(H+) ac 恒压条件下充入一定量的二氧化碳气体
)> c(OHˉ) > c(H+) ac 恒压条件下充入一定量的二氧化碳气体
【解析】
(3)初始投料为3molFe2O3和3molCO,Fe2O3和Fe均为固体,容器恒容,则根据反应方程式可知反应过程中气体的总物质的量不变,始终为3mol;平衡时CO2的体积分数为80%,即物质的量分数为80%,所以n(CO2)=3mol×80%=2.4mol,n(CO)=0.6mol。
(1)当△G=△H-T△S<0时反应可以自发进行,反应iv的焓变△H4>0,该反应为气体分子数增多的反应,所以△S>0,不能满足任何温度下△G都小于0,所以该反应不能在任何温度下自发进行;
(2)已知:i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
由盖斯定律可知![]() (iv-ii×3)得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=
(iv-ii×3)得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=![]() [+460kJ/mol-(+172kJ/mol)×3]= -28kJ/mol;
[+460kJ/mol-(+172kJ/mol)×3]= -28kJ/mol;
(3)①根据分析可知0-5min内△n(CO2)=2.4mol,容器的容积为10L,所以v(CO2)=![]() =0.048mol·L-1·min-1;
=0.048mol·L-1·min-1;
②平衡时c(CO2)=0.24mol/L,c(CO)=0.06mol/L,平衡常数K=![]() =64;
=64;
③混合气体中n(CO2)=2.4mol,1L3.6mol/L的NaOH溶液中n(NaOH)=3.6mol,n(CO2): n(NaOH:2:3,所以该反应的离子方程式为2CO2+3OHˉ=CO![]() +HCO
+HCO![]() +H2O,反应后溶液中的溶质为等物质的量浓度的Na2CO3和NaHCO3;Na+不发生水解,所以c(Na+)最大;碳酸根的水解程度大于碳酸氢根,所以c(HCO
+H2O,反应后溶液中的溶质为等物质的量浓度的Na2CO3和NaHCO3;Na+不发生水解,所以c(Na+)最大;碳酸根的水解程度大于碳酸氢根,所以c(HCO![]() )>c(CO
)>c(CO![]() ;溶液显碱性,所以c(OHˉ) > c(H+),水解是微弱的,所以溶液中离子浓度由大到小为c(Na+)> c(HCO
;溶液显碱性,所以c(OHˉ) > c(H+),水解是微弱的,所以溶液中离子浓度由大到小为c(Na+)> c(HCO![]() )>c(CO
)>c(CO![]() )> c(OHˉ) > c(H+);
)> c(OHˉ) > c(H+);
④a.固体的物质的量不再变化,说明正逆反应速率相等,反应达到平衡状态,故a能说明;
b.反应前后气体物质的量始终不变,体系的压强始终保持不变,不能说明反应达到平衡状态,故b不能说明;
c.反应前后气体质量变化,气体物质的量不变,所以未平衡时混合气体的平均摩尔质量会发生改变,当其保持不变说明反应达到平衡状态,故c能说明;
d.消耗CO和生成CO2均为正反应,只要反应发生单位时间内消耗CO和生成CO2的物质的量就相等,故其不能说明反应达到平衡状态,故d不能说明;
综上所述选ac;
(4)据图可知t2时刻正反应速率突然减小,然后又逐渐增大,之后达到平衡时与原平衡的反应速率相等,说明反应物的浓度先是被减小,然后又逐渐增大,则该条件改变后平衡逆向移动,该反应正反应为放热反应,升高温度可以使平衡逆向移动,但升高温度不能使正反应速率减小。而该反应前后气体分子数不变,若保持压强不变向密闭容器中充入二氧化碳,则容器的体积增大导致一氧化碳的浓度减小,正反应速率减小,则二氧化碳的浓度增大了,逆反应速率大于正反应速率,平衡向逆反应方向移动,根据温度不变K=![]() 不变,且压强不变时气体的浓度不变,所以再次平衡时正反应速率与原平衡相等。因此,改变的条件可能是:恒压条件下充入一定量的二氧化碳气体。
不变,且压强不变时气体的浓度不变,所以再次平衡时正反应速率与原平衡相等。因此,改变的条件可能是:恒压条件下充入一定量的二氧化碳气体。

【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化