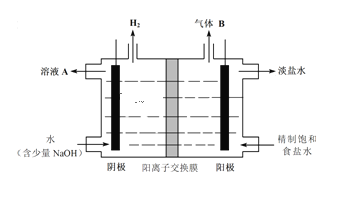
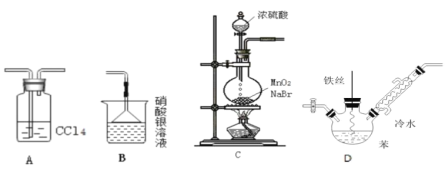
题目内容
【题目】下列工业生产所采取的措施和基本原理不一致的是( )
A.合成氨反应分离氨气以后的尾气循环使用,目的是充分利用原料
B.接触法制硫酸中,使用热交换器的目的是充分利用能源
C.侯氏制碱法比氨碱法更好的主要原因是前者更有利于保护环境
D.用氨水吸收制硫酸的尾气,目的是保护环境
【答案】C
【解析】
A.N2+3H2![]() 2NH3,该反应为可逆反应,不能完全转化,循环使用氮气和氢气,可以减少成本,提高原料利用率,A不符合题意;
2NH3,该反应为可逆反应,不能完全转化,循环使用氮气和氢气,可以减少成本,提高原料利用率,A不符合题意;
B.二氧化硫与氧气反应生成三氧化硫的反应为放热反应,使用热交换装置,充分利用可节约能源,B不符合题意;
C.侯氏制碱法比氨碱法更好的主要原因是:提高了食盐利用率,缩短了生产流程,降低了纯碱的成本,C符合题意。
D.用氨水吸收制硫酸的尾气中的二氧化硫,目的是保护环境,防止污染环境,D不符合题意;
答案选B。

【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,一定容积的密闭容器中,发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A. 25℃达到平衡时,向容器中继续通入CO,Ni粉转化率增大,CO转化率减小
B. 温度越低,越有利于Ni(CO)4的生产
C. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)<v(逆)
D. 平衡时向密闭容器中加入少量镍粉,平衡向正反应方向移动,新平衡时CO浓度比原平衡小
【题目】请同学们仔细阅读下表,并回答下列问题:
元素 | 甲 | 乙 | 丙 |
元素符号 | ① | Cl | O |
原子结构示意图 |
| ② | ③ |
周期 | 三 | ④ | 二 |
族 | ⑤ | ⅦA | ⅥA |
(1)写出①的元素符号___,②的原子结构示意图___,④的周期___,⑤的族___;
(2)甲元素最高价氧化物对应的水化物呈___性(填“酸”或“碱”),乙元素最高价氧化物对应的水化物的化学式为___,甲元素最高价氧化物对应的水化物与乙元素最高价氧化物对应的水化物相互反应的化学方程式为___;
(3)甲与乙两元素的单质反应生成物的电子式为___。