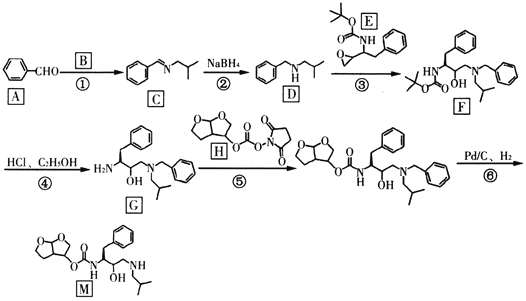
题目内容
【题目】钒基固溶体合金是一类重要的贮氢材料。某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、 TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含 VO(OH)2, Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品。制备共沉淀物的装置如下图:
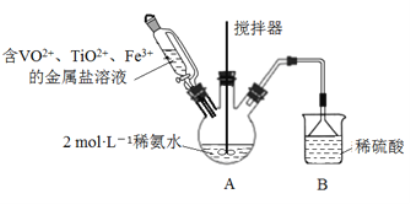
(1)用浓氨水配制500mL2mol·L-l的稀氨水,需用到的玻璃仪器有烧杯、胶头滴管和_____________。
(2)装置B的作用是__________________________。
(3)制备VO2+时,用草酸将VCV还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为__________________________。
(4)反应过程補控制温度为60℃,三颈烧瓶的加热方式是__________________________。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是__________________________。
②若过滤速度较慢,可采用__________________________(填操作名称)
③用无水乙醇洗涤:与水相比,使用无水乙醉洗涤的优点是:__________________________;简述洗涂的具体操作:_______________________________________。
④低温干燥,得共沉淀物。
(6)将(5)所得共沉淀物锻烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g 产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用 0.1000mol·L-1酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁(M=56)的质量分数为______________________(保留2位有效数字)。
【答案】500mL容量瓶 玻璃棒 量筒 吸收尾气中的氨气并防止倒吸 2VO2++4H++2Cl-=2VO2++2H2O+Cl2↑ 60℃水浴加热 取少量上层清液加入KSCN溶液,观察溶液是否变成血红色(或其他合理答案) 抽滤 乙醇易挥发容易干燥 向漏斗中加入无水乙醇至浸没沉淀,待乙醇自然流下后,重复操作23次,直至洗涤干净即可 11%
【解析】
(1)配制溶液需要烧杯、胶头滴管、500mL容量瓶、玻璃棒、量筒;
(2)B中吸收尾气;
(3)由信息可知盐酸将VO2+还原得VO2+,还生成氯气;
(4)控制温度为60℃,可水浴加热控制温度;
(5)①铁离子遇KSCN溶液为血红色;
②结合常见的过滤方式分析;
③使用无水乙醇洗涤,可减少固体溶解损失,且酒精易挥发;根据洗涤操作要点回答;
(6)由5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O及原子守恒可知5Fe~5Fe2+~MnO4-,以此计算。
(1)用浓氨水配制500mL2 molL-1的稀氨水,计算后量取、溶解、冷却、转移到500mL容量瓶中定容,则需用到的玻璃仪器有烧杯、胶头滴管和500mL容量瓶、玻璃棒、量筒;
(2)装置B的作用是吸收尾气中的氨气并防止倒吸;
(3)由信息可知盐酸将VO2+还原得VO2+,还生成氯气,由电子、电荷及原子守恒可知离子反应为2VO2++4H++2Cl-=2VO2++2H2O+Cl2↑;
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是60℃水浴加热;
(5)①检测上层清液是否含Fe3+的实验方案是取少量上层清液加入KSCN溶液,观察溶液是否变成血红色;
②若过滤速度较慢,可用抽滤代替,提升固液分离速率;
③使用无水乙醇洗涤的优点是乙醇易挥发容易干燥、减少洗涤时因固体溶解而损失;洗涤的具体操作要点是向漏斗中加入无水乙醇至浸没沉淀,待乙醇自然流下后,重复操作23次,直至洗涤干净即可;
(6)由5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O及原子守恒可知5Fe~5Fe2+~MnO4-,则产品中铁的质量分数为 11%。
11%。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
【题目】利用如图装置可以进行实验并能达到实验目的的是( )

选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用KMnO4和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与浓硝酸制取并收集纯净干燥的NO2 | 水 | 浓硫酸 |
C | 用生石灰与浓氨水制取并收集纯净干燥的NH3 | 水 | 浓硫酸 |
D | 用铜片和浓硫酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
A.AB.BC.CD.D