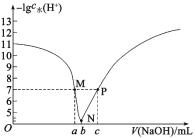
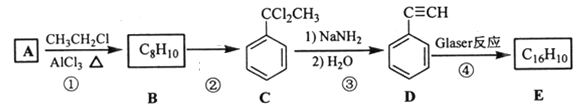
题目内容
【题目】CuS、Cu2S用于处理酸性废水中的Cr2O72-,反应如下:
反应Ⅰ:CuS+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
下列有关说法正确的是
A.反应Ⅰ和Ⅱ中各有2种元素的化合价发生变化
B.反应Ⅱ中还原剂与氧化剂的物质的量之比为3∶5
C.处理1mol Cr2O72-时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
D.质量相同时,Cu2S能去除更多的Cr2O72-
【答案】B
【解析】
A.由未配平的化学方程式可知,反应I中S、Cr元素化合价发生变化,反应II中Cu、S、Cr三种元素的化合价发生了变化,故A错误;
B. 反应Ⅱ中还原剂是Cu2S,氧化剂是Cr2O72-,二者反应的物质的量之比为3:5,故B正确;
C. 反应I方程式配平后为3CuS+4Cr2O72-+32H+=3Cu2++3SO42-+8Cr3++16H2O,反应II配平后的方程式为3Cu2S+5Cr2O72-+46H+=6Cu2++3SO42-+10Cr3++23H2O,由方程式可知处理1molCr2O72-时,反应I消耗H+的物质的量是8mol,反应Ⅱ消耗H+的物质的量是9.2mol,故C错误;
D. 根据方程式可知3mol CuS处理4mol Cr2O72-,每克处理Cr2O72-的物质的量为![]() ,3mol Cu2S处理5mol Cr2O72-,每克处理Cr2O72-的物质的量为
,3mol Cu2S处理5mol Cr2O72-,每克处理Cr2O72-的物质的量为![]() ,则质量相同时,CuS能去除更多的Cr2O72-,故D错误;
,则质量相同时,CuS能去除更多的Cr2O72-,故D错误;
故选B。

【题目】下列实验主要仪器和试剂的选择不能达到实验目的的是
选项 | 主要仪器 | 试剂 | 实验目的 |
A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
B | 酒精灯、玻璃棒、蒸发皿、三脚架 |
| 蒸发溶液得到晶体 |
C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
A.AB.BC.CD.D