题目内容
【题目】向密闭容器中充入物质的量浓度均为0.1 molL-1的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
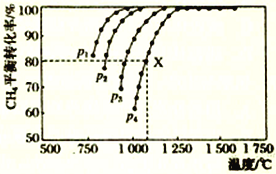
A. 随着温度升高,该反应的平衡常数减小
B. 1100℃,p4条件下,该反应10min时达到平衡点X,则v(CO2)=0.008mol·L-1·min-1
C. p1、p2、p3、p4大小的顺序为p1<p2<p3<p4
D. 平衡时CO与H2的物质的量比为1∶1
【答案】A
【解析】A. 由图可知压强一定时,随着温度升高,CH4的平衡转化率增大,使得该反应的平衡常数增大,故A不正确;B. 1100℃,p4条件下,该反应10min时达到平衡点X,则v(CO2)= v(CH4)=0.008mol·L-1·min-1,故B正确;C.由图可知温度一定时,CH4的平衡转化率随p1、p2、p3、p4减小,加压平衡左移,CH4的平衡转化率减小,所以p1<p2<p3<p4,故C正确;D. 由于从反应物开始反应,生成物CO与H2的化学计量数比为1:1,所以平衡时CO与H2的物质的量比为1∶1,故D正确。故选A。

 口算题卡北京妇女儿童出版社系列答案
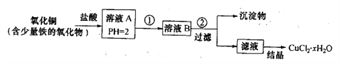
口算题卡北京妇女儿童出版社系列答案【题目】硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.3 | 4.0 | 7.6 | 8.4 |
完全沉淀pH | 4.1 | 5.2 | 9.6 | 10.8 |
根据题意回答下列问题:
(1)请提出两条加快酸解速率的措施__________________。
(2)滤渣的主要成分除MnO2及矿物中其他不溶性杂质外还有_____________ (填化学式),写出生成MnO2的离子方程式_____________ 。
(3)在除去滤渣之前,往往还加一定物质再次调节pH,请选择合适的物质________
A.NaOH B.MgO C.Mg(OH)2 D.氨水
根据表格给出数据写出调节pH的范围___________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 20 | 50 | 60 | 70 |
MgSO4 | 25.0 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgS4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤___________。再将滤液进行“操作1”,则析出晶体后的溶液(20℃) 中,C(Mg2+)=___________mol/L(该混合溶液的密度为1.2g·cm-3)。