题目内容
【题目】硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.3 | 4.0 | 7.6 | 8.4 |
完全沉淀pH | 4.1 | 5.2 | 9.6 | 10.8 |
根据题意回答下列问题:
(1)请提出两条加快酸解速率的措施__________________。
(2)滤渣的主要成分除MnO2及矿物中其他不溶性杂质外还有_____________ (填化学式),写出生成MnO2的离子方程式_____________ 。
(3)在除去滤渣之前,往往还加一定物质再次调节pH,请选择合适的物质________
A.NaOH B.MgO C.Mg(OH)2 D.氨水
根据表格给出数据写出调节pH的范围___________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 20 | 50 | 60 | 70 |
MgSO4 | 25.0 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgS4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤___________。再将滤液进行“操作1”,则析出晶体后的溶液(20℃) 中,C(Mg2+)=___________mol/L(该混合溶液的密度为1.2g·cm-3)。
【答案】 加热、搅拌、适当提高酸的浓度和将矿物泥粉碎增大接触面积等 Fe(OH)3、SiO2和Al(OH)3 Mn2++ClO-+H2O═MnO2↓+2H++Cl- BC 5.2≤pH<8.4 蒸发结晶,趁热过滤 2 molL-1
【解析】硼镁泥主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体。(1)加热、搅拌、适当提高酸的浓度或将矿物泥粉碎增大接触面积等都可加快反应速率。(2)根据以上分析可知滤渣的主要成分除MnO2及矿物中其他不溶性杂质外还有Fe(OH)3、SiO2和Al(OH)3,NaClO与Mn2+反应产生MnO2沉淀,则生成MnO2的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-。(3)由于不能引入新杂质,则应该选择MgO或Mg(OH)2,答案选BC;根据表格给出数据可知铝完全沉淀时pH为5.2,超过8.4时镁离子开始沉淀,因此调节pH的范围应该是5.2≤pH<8.4;(4)由温度对硫酸镁、硫酸钙的溶解度影响可知,温度越高,硫酸钙溶解度越小,因此可以采用蒸发结晶,趁热过滤方法除去硫酸钙;假设20℃时饱和MgSO4溶液质量为125g,其体积为125g÷1.20gcm3;所含溶质MgSO4的质量为25g,物质的量为25g÷120g/mol;则溶液里c(Mg2+)=c(MgSO4)= 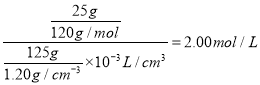 。
。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案