题目内容
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D. 恒温时将气体体积缩小到原来的一半,达到新平衡时CO浓度将要减小
【答案】B
【解析】A、根据题中平衡常数数据分析,平衡常数随温度升高减小,说明平衡逆向进行,逆反应是吸热反应,正反应是放热反应,选项A错误;B、80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 molL-1,Qc=![]() =
= ![]() =8>2,说明平衡逆向进行,则此时v(正)<v(逆),选项B正确;C、恒温恒压下,向容器中再充入少量的Ar,压强增大保持恒压,平衡向气体体积增大的方向进行,上述平衡将逆向移动,选项C错误;D、恒温时将气体体积缩小到原来的一半,,相当于增大压强平衡正向进行,达到新平衡时,CO的百分含量将减小,选项D错误。答案选B。
=8>2,说明平衡逆向进行,则此时v(正)<v(逆),选项B正确;C、恒温恒压下,向容器中再充入少量的Ar,压强增大保持恒压,平衡向气体体积增大的方向进行,上述平衡将逆向移动,选项C错误;D、恒温时将气体体积缩小到原来的一半,,相当于增大压强平衡正向进行,达到新平衡时,CO的百分含量将减小,选项D错误。答案选B。

 名题金卷系列答案
名题金卷系列答案【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,在工业上有重要的用途。
(1)已知:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H1;
2ClNO(g)+H2O(g)=NO(g)+2HCl(g ) △H2。
则反应:4ClNO(g)+O2(g)=2Cl2(g)+2N2O3(g)的△H=_______(用含△H1、△H2 的代数式表示 )。
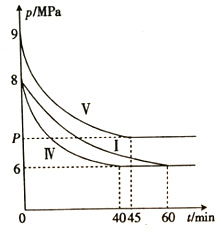
(2)将NO与Cl2按物质的量之比2:1充入一绝热密闭容器中,发生反应:
2NO(g)+Cl2(g) ![]() 2ClNO(g) △H<0,实验测得NO的转化率α(NO)随时间的变化如图所示。
2ClNO(g) △H<0,实验测得NO的转化率α(NO)随时间的变化如图所示。
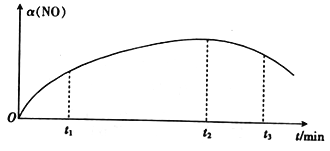
NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是___________。
(3)在其他条件相同时,向五个恒温恒容的密闭容器中分别充入1mol Cl2 与2 mol NO,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,部分反应条件及平衡时Cl2 的转化率如下表所示。
2ClNO(g) △H<0,部分反应条件及平衡时Cl2 的转化率如下表所示。
容器编号 | 温度/℃ | 容器体积/L | 平衡时Cl2 的转化率 |
I | T1 | 2 | 75% |
II | T2=T1 | 3 | ω2 |
Ⅲ | T3>T1 | V3 | 75 % |
Ⅳ | T4 | V4 | ω4 |
V | T5 | V5 | ω5 |
①6 min时容器I中反应达到平衡,则0~6 min内,v(NO)=______mol·L-l·min-1。
②V3______(填“ > ”“<”或“ = ”) 2。
③容器I中反应的平衡常数的值K2=______,容器Ⅲ中反应的平衡常数的值K3=_____(填“>”“<”或“=”)K2。
④容器Ⅳ、容器V分别与容器I相比只有一个实验条件不同,反应体系总压强随时间的变化如图所示。与容器I相比,容器Ⅳ改变的实验条件是_______;容器V与容器I 的体积不同,则容器V中反应达到平衡时气体总压强(P)的范围是________。