题目内容
下列说法正确的是( )
| A、若以w1和w2分别表示浓度为a mol?L-1和b mol?L-1氨水的质量分数,且知2a=b,则w2>2w1(氨水的密度比纯水的小) |
| B、7.8g Na2O2与CO2完全反应,转移0.2mol电子 |
| C、CO2、SO3、NO2和水反应均能生成酸,都属于酸性氧化物 |
| D、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
考点:酸、碱、盐、氧化物的概念及其相互联系,氨的物理性质,钠的重要化合物
专题:元素及其化合物
分析:A、根据c=
表示氨水的物质的量浓度,结合氨水的浓度越大密度越小,进行判断;
B、根据反应方程式结合化合价的变化分析;
C、凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物;
D、Na2CO3受热不分解.
| 1000ρw |
| M |
B、根据反应方程式结合化合价的变化分析;
C、凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物;
D、Na2CO3受热不分解.
解答:
解:A、设质量分数w1的氨水密度为ρ1g/mL,质量分数w2的氨水的为ρ2g/mL,
质量分数w1的氨水的物质量浓度为a=
mol/L,
质量分数w2的氨水的物质量浓度为b=
mol/L,
由于2a=b,所以2×
mol/L=
mol/L,故2ρ1w1=ρ2w2,氨水的浓度越大密度越小,所以ρ1>ρ2,故w2>2w1,故A正确;
B、反应2Na2O2+2CO2=2Na2CO3+O2中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂,O元素化合价分别由-1价升高为0价、降低为-2价,则消耗2molNa2O2生成1molO2,转移2mol电子,所以7.8g 即0.1molNa2O2与CO2完全反应,转移0.1mol电子,故B错误;
C、NO2和水反应生成硝酸和NO,不是酸性氧化物,故C错误;
D、NaHCO3、(NH4)2CO3受热分解生成二氧化碳气体,Na2CO3受热不分解,故D错误.
故选A.
质量分数w1的氨水的物质量浓度为a=
| 1000ρ1w1 |
| 17 |
质量分数w2的氨水的物质量浓度为b=
| 1000ρ2w2 |
| 17 |
由于2a=b,所以2×
| 1000ρ1w1 |
| 17 |
| 1000ρ2w2 |
| 17 |
B、反应2Na2O2+2CO2=2Na2CO3+O2中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂,O元素化合价分别由-1价升高为0价、降低为-2价,则消耗2molNa2O2生成1molO2,转移2mol电子,所以7.8g 即0.1molNa2O2与CO2完全反应,转移0.1mol电子,故B错误;
C、NO2和水反应生成硝酸和NO,不是酸性氧化物,故C错误;
D、NaHCO3、(NH4)2CO3受热分解生成二氧化碳气体,Na2CO3受热不分解,故D错误.
故选A.
点评:本题考查了氧化还原反应、物质的量浓度的有关计算,难度中等,关键理解物质的量浓度与质量分数之间的关系,注意氨水的浓度越大、密度越小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有机物的分子中,当它含有下列的一种官能团时,既能发生取代反应,氧化反应,酯化反应,又能发生消去反应的是( )
| A、-COOH |
B、 |
| C、-OH |
D、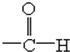 |
实验室中需用480mL 0.2mol/L的Na2CO3溶液,配制时需要无水Na2CO3的质量是( )
| A、10.60g |
| B、10.18g |
| C、21.2g |
| D、5.30g |
将下列物质投入到盐酸中,不会有气泡生成的是( )
| A、Na |
| B、Na2O |
| C、Na2O2 |
| D、Na2CO3 |
下列说法正确的是( )
| A、垃圾资源化的主要途径是卫生填埋 |
| B、浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 |
| C、硅是现代光学及光纤制品的基本原料 |
| D、铁粉可作抗氧化剂 |
下列反应最终无沉淀生成的是( )
| A、Na2SiO3溶液中加入过量盐酸 |
| B、NaAlO2溶液中通入过量CO2 |
| C、饱和Na2CO3溶液中通入过量的CO2 |
| D、AgNO3溶液中滴加氨水至过量 |
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、矿泉水 |
| B、稀HCl |
| C、FeCl3溶液 |
| D、Fe(OH)3胶体 |
根据下列实验不能证明一元酸HR为弱酸的是( )
| A、室温时,NaR溶液的pH大于7 |
| B、同等浓度等体积盐酸分别与Zn反应产生H2量相同 |
| C、HR溶液加入少量NaR固体,溶解后溶液的pH变大 |
| D、室温时,0.01mol?L-1的HR溶液pH=4 |
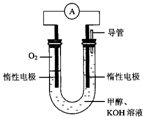 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.