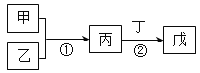
��Ŀ����
����Ŀ�����ᱵ����Ϊ�������մɹ�ҵ��֧��������ҵ��ȡ������ͼ���Ȼ�ò����Բ������ѱ�����[BaTiO(C2O4)24H2O]�����պ�ɻ�����ᱵ���塣
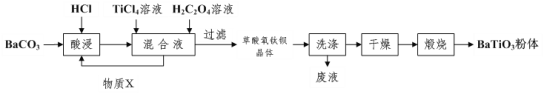
��1�����ʱ�����ķ�Ӧ�����ӷ���ʽΪ___��
��2������TiCl4��Һʱͨ����TiCl4��������Ũ�����ټ�ˮϡ�ͣ���Ŀ����___��
��3������H2C2O4��Һʱ��������Ӧ�Ļ�ѧ����ʽΪ___����ѭ��ʹ�õ�����X��___���ѧʽ�������ʵ�鷽����֤�������ѱ������Ƿ�ϴ�Ӹɾ���___��
��4�����ղ������ѱ�����õ�BaTiO3��ͬʱ�����ɸ����µ���̬������CO��___��
��5����ҵ���ñ���Na2CO3��Һ�����ؾ�ʯ����Ҫ�ɷ���BaSO4�������ﵽƽ��������ϲ���Һ���ظ���β���������ת��Ϊ���������BaCO3������BaCO3�Ʊ��������Ρ���֪�����£�Ksp(BaSO4)��1.0��10��10��Ksp(BaCO3)��2.59��10��9������������Ҫ___molL��1��̼������Һ���ݲ���ʵ������ת��������CO32����ˮ�⣩��
���𰸡�BaCO3+2H+=Ba2++CO2��+H2O ����TiCl4��ˮ�� BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)24H2O��+6HCl HCl ȡ���һ��ϴ��Һ���������������ữ�������������������ɣ���˵�������Ѿ�ϴ�Ӹɾ� CO2��H2O��g�� 2.59��10-4
��������
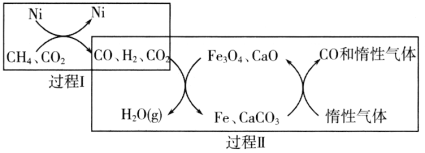
���Ʊ����̿�֪��̼�ᱵ�����ᷴӦ�����Ȼ�����Ȼ���Ȼ��������Ȼ�̼�����ᷴӦ����BaTiO(C2O4)24H2O�����ˡ�ϴ�ӡ�������յõ�BaTiO3��
(1)̼�ᱵ�����ᷴӦ�����Ȼ�����ˮ��������̼��
(2)TiCl4�ɷ���ˮ�ⷴӦ��
(3)����H2C2O4��Һ���ɲ������ѱ����壬ͬʱ����HCl��ѭ��ʹ�ã�������������������Ƿ�ϴ�Ӹɾ���
(4)BaTiO(C2O4)24H2O���գ������ֽⷴӦ�����ɸ����µ����������CO��CO2��H2O(g)��
(5)����Ksp(BaSO4)���㱥����Һ����������ӵ�Ũ�ȣ��ٸ���ƽ�ⳣ������c(CO32��)��
(1)̼�ᱵ�����ᷴӦ�����Ȼ�����ˮ��������̼�����ӷ�ӦΪBaCO3+2H+��Ba2++CO2��+H2O��
(2)TiCl4�ɷ���ˮ�ⷴӦ����ͨ����TiCl4����Ũ���ᣬĿ��������TiCl4��ˮ�⣻
(3)����H2C2O4��Һ���ɲ������ѱ����壬��ӦΪBaCl2+TiCl4+2H2C2O4+5H2O��BaTiO(C2O4)24H2O��+6HCl��ͬʱ����HCl(������)��ѭ��ʹ�ã���������Ƿ�ϴ�Ӹɾ�����ȡ���һ��ϴ��Һ���������������ữ�������������������ɣ���˵�������Ѿ�ϴ�Ӹɾ���
(4)BaTiO(C2O4)24H2O���գ������ֽⷴӦ����Ԫ���غ��֪�����ɸ����µ����������CO��CO2��H2O(g)��
(5)��֪Ksp(BaSO4)��1.0��10��10�������ᱵ��Һ����������ӵ�Ũ��c(SO42��)��![]() ��1.0��10��5mol/L����c(CO32��)��
��1.0��10��5mol/L����c(CO32��)��![]() mol/L��2.59��10��4mol/L��
mol/L��2.59��10��4mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�