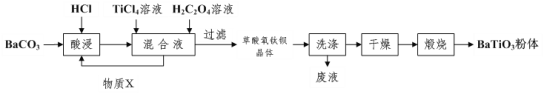
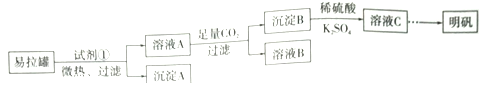
题目内容
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。
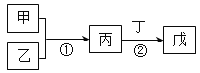
(1)若甲由短周期中原子半径最大的金属元素组成,请写出丙中18电子双原子阴离子的电子式___。
(2)若乙、丁混合或丙、丁混合均产生白烟,则戊所含的化学键有___。
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则戊的水溶液在空气中加热直至灼烧最后得到的固体物质为___。
(4)若丙是一种有刺激性气味的气体,常温下0.1mol/L戊溶液的pH=0.7,请写出反应②的离子方程式___。
(5)若反应①是常见的可逆反应、放热反应,该反应的适宜条件是:铁触媒做催化剂,温度700K左右,压强30-50Mpa。戊是一种酸式盐。请写出戊的阴离子电离方程式___。
【答案】![]() 离子键和共价键 Al2O3或Al2(SO4)3或NaAlO2 SO2+H2O2=2H++SO42- HSO4-=H++SO42-或HSO3-
离子键和共价键 Al2O3或Al2(SO4)3或NaAlO2 SO2+H2O2=2H++SO42- HSO4-=H++SO42-或HSO3-![]() H++SO32-
H++SO32-
【解析】
(1)甲为短周期中原子半径最大的元素,则为钠;丙中阴离子核外有18个电子,则单质乙中元素的质子数应小于9,从而确定其为O,丙中阴离子为O22-。
(2)白烟通常为盐,最常见的是NH4Cl,生成它的气体要么为Cl2、NH3,要么为HCl、NH3;
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则甲为Al,丙为Al2O3,丁能溶解Al2O3,则其为酸,可能为盐酸、硝酸或硫酸,也可能为强碱,由此可得出戊的组成。
(4)常温下0.1mol/L戊溶液的pH=0.7,则其为二元强酸,即为硫酸,所以丙为SO2,丁为H2O2。
(5)若反应①是常见的可逆反应、放热反应,该反应的适宜条件是:铁触媒做催化剂,温度700K左右,压强30-50Mpa,则为工业合成氨的反应,戊是一种酸式盐,则丁为二元酸,可能为硫酸,可能为亚硫酸,从而得出戊可能为硫酸氢盐,可能为亚硫酸氢盐。
(1)由前面分析可知,甲为钠,则乙为O2,丙为Na2O2,其阴离子为O22-,电子式为
![]() ;答案为
;答案为![]() 。
。
(2)若乙、丁混合或丙、丁混合均产生白烟,由于乙为单质,则丁为NH3,丙为HCl,乙为Cl2,甲为H2,戊为NH4Cl,则戊所含的化学键有离子键和共价键;答案:离子键和共价键。
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则甲为Al,丙为Al2O3,乙为O2,丁能溶解Al2O3,则其为酸,可能为盐酸、硝酸或硫酸,也可能为NaOH,从而得出戊可能为AlCl3、Al(NO3)3、Al2(SO4)3、NaAlO2。若戊为AlCl3、Al(NO3)3,存在反应AlCl3+3H2O![]() Al(OH)3+3HCl↑,Al(NO3)3+3H2O
Al(OH)3+3HCl↑,Al(NO3)3+3H2O![]() Al(OH)3+3HNO3↑,2Al(OH)3
Al(OH)3+3HNO3↑,2Al(OH)3![]() Al2O3+3H2O,则最终所得固体为Al2O3;若戊为Al2(SO4)3,则最终所得固体为Al2(SO4)3;若戊为NaAlO2,则最终所得固体为NaAlO2。答案:Al2O3或Al2(SO4)3或NaAlO2。
Al2O3+3H2O,则最终所得固体为Al2O3;若戊为Al2(SO4)3,则最终所得固体为Al2(SO4)3;若戊为NaAlO2,则最终所得固体为NaAlO2。答案:Al2O3或Al2(SO4)3或NaAlO2。
(4)常温下0.1mol/L戊溶液的pH=0.7,则其为二元强酸,即为硫酸,所以丙为SO2,丁为H2O2,反应②的离子方程式SO2+H2O2=2H++SO42-。答案:SO2+H2O2=2H++SO42-。
(5)反应①是工业合成氨的反应,戊是一种酸式盐,则丁为二元酸,可能为硫酸,可能为亚硫酸,从而得出戊可能为硫酸氢铵,可能为亚硫酸氢铵。戊的阴离子电离方程式HSO4-=H++SO42-或HSO3-![]() H++SO32-。答案:HSO4-=H++SO42-或HSO3-
H++SO32-。答案:HSO4-=H++SO42-或HSO3-![]() H++SO32-。
H++SO32-。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案