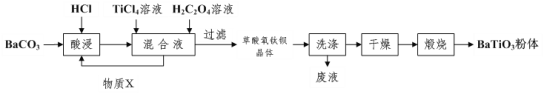
题目内容
【题目】碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq) ΔH2
I2(aq) ΔH2
反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=___(用ΔH1、ΔH2表示)。
②分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
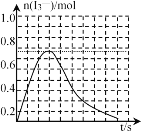
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)![]() I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___。
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:___。
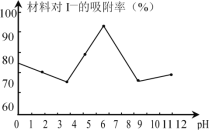
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___(填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)![]() AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___[用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___。
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___[用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___。
【答案】ΔH1+2ΔH2 bc 开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq)![]() I3-(aq)的反应平衡向右移动,n(I3-)不断增加 5Cl2+I2+6H2O=2IO3-+10Cl-+12H+ 中性
I3-(aq)的反应平衡向右移动,n(I3-)不断增加 5Cl2+I2+6H2O=2IO3-+10Cl-+12H+ 中性 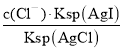 AgI的溶度积比AgCl的溶度积小
AgI的溶度积比AgCl的溶度积小
【解析】
(1)①SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)①△H1;HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2,据此进行分析;
I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2,据此进行分析;
②a.反应Ⅲ△S>0、△H>0,如能自发进行,应满足△H﹣T△S<0;
b.氧化还原反应中还原剂的还原性大于还原产物的还原性;
c.分解水制备氢气,应不断补充H2O;
d.循环过程中产生1mol O2同时产生2mol H2;
③开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I﹣(aq)I3﹣(aq)的反应平衡向右移动,n(I3﹣)不断增加;
(2)氯气与碘单质反应生成碘酸根离子和氯离子;
(3)由图象可知pH=7时,吸附效果最好;
(4)Ksp(AgCl)=c(Ag+)c(Cl﹣),则c(Ag+)=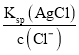 ,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=
,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=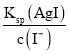 ,故
,故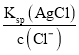 =
=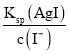 ,且AgI的溶度积比AgCl的溶度积小。
,且AgI的溶度积比AgCl的溶度积小。
(1)①SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)①△H1;HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2;
I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2;
②a.反应Ⅲ△S>0、△H>0,在高温下可满足△H﹣T△S<0,故a错误;
b.氧化还原反应中还原剂的还原性大于还原产物的还原性,还原性SO2还原性比HI强,故b正确;
c.分解水制备氢气,应不断补充H2O,故c正确;
d.循环过程中产生1mol O2同时产生2mol H2,故d错误,
故答案为:bc;
③N(I3﹣)逐渐增大的原因是,开始阶段,SO2和I2反应生成的I﹣的浓度不断增大,I2(aq)+I﹣(aq)I3﹣(aq)的反应平衡向右移动,n(I3﹣)不断增加;
(2)氯气过量就能将碘单质进一步氧化成碘酸根离子,故氯气与碘单质反应的离子方程式为5Cl2+I2+7H2O=2IO3﹣+10Cl﹣+12H+;
(3)据图象分析pH=7时,吸附效果最好,故最适合吸附的是中性;
(4) Ksp(AgCl)=c(Ag+)c(Cl﹣),则c(Ag+)=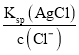 ,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=
,Ksp(AgI)=c(Ag+)c(I﹣),则c(Ag+)=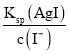 ,故
,故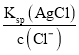 =
=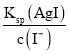 ,,故c(I﹣)=
,,故c(I﹣)=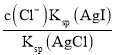 ,该方法去除碘离子的原理是利用AgI的溶度积比AgCl的溶度积小。
,该方法去除碘离子的原理是利用AgI的溶度积比AgCl的溶度积小。

 阅读快车系列答案
阅读快车系列答案