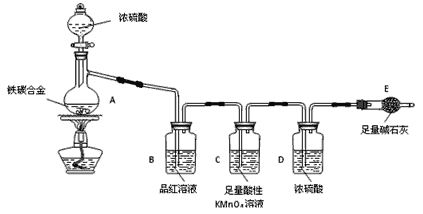
题目内容
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为 NA
B. 通常状况下,NA 个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
【答案】D
【解析】试题分析:A.标准状况下水是液态,不能适用于气体摩尔体积,则22.4LH2O含有的分子数不是NA,A错误;B.通常状况下气体的摩尔体积不是22.4L/mol,NA个CO2分子占有的体积不是22.4L,B错误;C.物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—的浓度是2mol/L,但不能确定溶液体积,则个数不是2NA,C错误;D.常温常压下,1.06g Na2CO3的物质的量是![]() ,含有的Na+离子数为0.02 NA,D正确,答案选D。
,含有的Na+离子数为0.02 NA,D正确,答案选D。

【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质 (以C 计)与水蒸气反应制取H2是种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
II CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
III CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
IV C(s)+O2(g)=CO2
V CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
A.容器内压强不再变化 B. H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成a molH-H键的同时断裂2amolH-O键
(2)对于反应I,不同温度和压强对H2产率影响如下表。
温度 | 压强p1/Mpa | 压强p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是__________________。

(3)已知反应Ⅱ的ΔH=-41.1kJ/mol,C=O、O-H、H-H的键能分别为 803 kJ/mol,464 kJ/mol、436 kJ/mol,则CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为___________;当重新平衡后,CO2浓度___________(填“变大”“ 变小”“ 不变”)。
(5)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:

请回答下列问题:
①Pt(a)电极是电池的_______极,电极反应式为______________________;
②常温下,用此电池以惰性电极电解0.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH=_________(忽略溶液的体积变化)。