题目内容
4.科学探究的基本程序包括形成问题、建立假设、设计研究方案、检验假设、表达或交流结果等.某同学欲用如图装置可用来探究浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,请填写下列空白:
(1)写出木炭粉与浓硫酸反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O
(2)②中A瓶品红的作用是检验有无S02生成.B瓶酸性高锰酸钾的作用除去生成的S02气体C瓶品红溶液的作用是检验S02是否除尽.
(3)如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③:则可以检出的物质是CO2、SO2,不能检出的物质是H2O.
(4)如果将仪器的连接顺序变为①、③、②,则不能检出的物质是CO2、SO2.
(5)如果将仪器的连接顺序变为②、③、①,则不能检出的物质是H2O.
分析 (1)木炭粉与浓硫酸反应生成SO2和CO2、水;
(2)A品红溶液用于检验二氧化硫气体;检验二氧化碳前必须确保混合气体中不含二氧化硫,所以B中酸性高锰酸钾溶液用于除去二氧化硫,C中品红溶液用于检验二氧化硫是否已经除尽;
(3)用无水硫酸铜来检验水的生成,用品红检验二氧化硫的生成,用澄清石灰水检验二氧化碳的生成,但是二氧化碳检验之前需要先把二氧化硫除净;
(4)二氧化碳和二氧化硫均可以使澄清的石灰水变浑浊;
(5)将混合气体通过某种水溶液之后,再检验水的存在与否是错误的,因为这些水溶液中含有水.
解答 解:(1)木炭粉与浓硫酸反应生成SO2和CO2,反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O;
(2)SO2能使品红溶液褪色以及酸性高锰酸钾溶液褪色,②中A瓶品红的作用是检验有无S02生成,B瓶酸性高锰酸钾的作用除去生成的S02气体,C瓶品红溶液的作用是检验S02是否除尽,从而避免的二氧化硫对二氧化碳的检验的干扰,
故答案为:检验有无S02生成;除去生成的S02气体;检验S02是否除尽;
(2)如果将装置中①、②、③三部分仪器的连接顺序改为②可以检验并除去二氧化硫,①可以检验水的存在,但是不一定是混合气体中的水,③可以检验二氧化碳的存在,
故答案为:CO2、SO2;H2O;
(3)如果将仪器的连接顺序变为①、③、②,通过①可以确定水的存在,二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,则无法检验CO2、SO2,
故答案为:CO2、SO2;
(4)如果将仪器的连接顺序变为②、③、①,则②可以检出的物质是二氧化硫,并可以将二氧化硫除净,③检验出的事二氧化碳,但是①检验时一定会有水,这些水必要一定是原来混合气体中的水,所以不能检验出水,
故答案为:H2O.
点评 本题考查学生浓硫酸的性质及常见气体的检验,题目难度中等,明确产物检验所用的试剂以及检验的先后顺序为解答关键,注意熟练掌握浓硫酸的化学性质及常见气体的检验方法.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | 如果大量苯溶入水中渗入土壤,会对周边农田、水源造成严重污染 | |
| B. | 可以采取抽吸水渠中上层液体的办法,达到部分清除泄漏物的目的 | |
| C. | 由于苯是一种易挥发、易燃的物质,周围地区如果有一个火星就可能引起爆炸 | |
| D. | 事故发生地周围比较空旷,有人提议用点火焚烧的办法来清除泄漏物,会产生大量浓烟,所以该方法未被采纳 |
| A. | 干冰气化 | B. | 加热氯化铵 | C. | 食盐熔化 | D. | 氯化氢溶于水 |
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
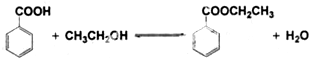
已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10mL 95%的乙醇(过量),8mL环己烷以及3mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,控制温度在65~70℃加热回流2h.利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
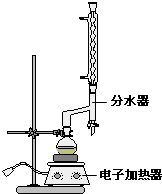
②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性.用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分.
④检验合格,测得产品体积为2.3mL.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①加入沸石的作用是防止暴沸.如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:冷却后补加
(3)步骤①中使用分水器不断分离除去水的目的是使平衡不断地向正向移动
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须检查是否漏水
(6)计算本实验的产率为49.1%.
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
| A. | 金刚石 | B. | 晶体硅 | C. | 石英(SiO2) | D. | MgO |
