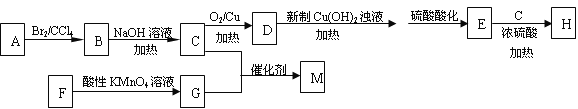
题目内容
【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:

注:经检验黑色固体为Ag。
①白色沉淀的化学式是______________________。
②甲同学得出Ag+氧化了Fe2+的依据是_________________。

(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是______________________。
②b中电压表指针逆向偏移后,银为_______________极(填“正”或“负”)。
③由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:

①实验Ⅲ_________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_______________。
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因_____________________。
【答案】(1)①Ag2SO4 ② 有黑色固体(Ag)生成,加入KSCN溶液后变红
(2)① Fe2+ -e-=Fe3+ ② 负 ③ Fe2++Ag+ ![]() Fe3++Ag
Fe3++Ag
(3)①不能 因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag。② 溶液中存在平衡:Fe3++Ag![]() Fe2+ +Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大。(或促使平衡正向移动,银镜溶解)
Fe2+ +Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大。(或促使平衡正向移动,银镜溶解)
【解析】
试题分析: (1)①银离子与硫酸根反应生成硫酸银沉淀;②Ag+氧化了Fe2+自身被还原成单质银,二价铁被氧化成三价,银是黑色固体,三价铁用KSCN溶液检验显示红色。
(2)①电子由石墨经导线流向银,故石墨一极是负极,发生氧化反应Fe2+ -e-=Fe3+;②b中电压表指针逆向偏移,说明电子流向颠倒了,则银为负极;③实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+ ![]() Fe3++Ag。
Fe3++Ag。
(3)①因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag,故不能证明Fe3+氧化了Ag;②溶液中存在平衡:Fe3++Ag![]() Fe2+ +Ag+,且 AgCl比Ag2SO4溶解度更小, Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大。
Fe2+ +Ag+,且 AgCl比Ag2SO4溶解度更小, Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大。

 名校课堂系列答案
名校课堂系列答案