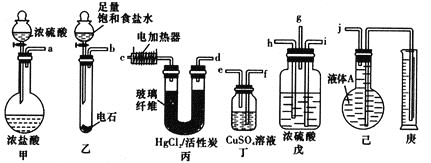
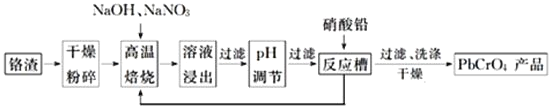
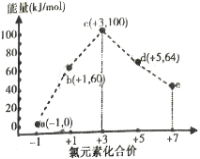
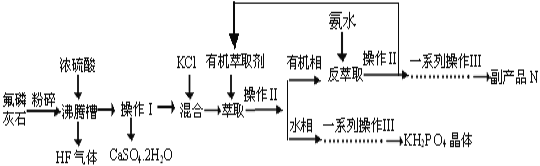
题目内容
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、
、![]() 、
、![]()
C.0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO-、![]()
D.0.1mol·L-1NaOH溶液:Mg2+、Na+、![]() 、
、![]()
【答案】B
【解析】
A.I-具有还原性,ClO-具有强氧化性,I-与ClO-发生氧化还原反应,在溶液中不能大量共存,A不满足题意;
B.0.1 mol·L1的Fe2(SO4)3溶液中,Cu2+、![]() 、
、![]() 、
、![]() 之间不反应,都不与Fe2(SO4)3反应,在溶液中能大量共存,B满足题意;
之间不反应,都不与Fe2(SO4)3反应,在溶液中能大量共存,B满足题意;
C.0.1 mol·L1的HCl溶液中,CH3COO与H+反应生成弱电解质CH3COOH,在溶液中不能大量共存,C不满足题意;
D.0.1 mol·L1的NaOH溶液中,Mg2+、![]() 与NaOH溶液反应,在溶液中不能大量共存,D不满足题意;
与NaOH溶液反应,在溶液中不能大量共存,D不满足题意;
答案选B。

【题目】用0.1500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.60 |
回答下列问题:
(1)实验中,需要润洗的仪器是:________________________(填写仪器名称)。
(2)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是______________
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则消耗盐酸溶液的体积为________mL。
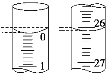
(4)下列操作中会使所测结果偏高的是_________________、偏低的是_________________
①酸式滴定管漏液;②滴定前酸式滴定管尖嘴部分有气泡,滴定过程中气泡变小;③滴定过程中,振荡锥形瓶时,不小心将溶液溅出;④滴定过程中,锥形瓶内加少量蒸馏水; ⑤用甲基橙作指示剂进行滴定时,溶液由橙色变红色时停止滴定;⑥用甲基橙作指示剂,溶液由黄色变橙色,5 s后又变为黄色。⑦读酸式滴定管读数时,滴定前仰视读数
(5)未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。