题目内容
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(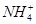 )由大到小的顺序为________;
)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++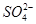 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(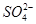 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
(1)> 加水稀释使平衡CH3COO-+H2O CH3COOH+OH-右移 >
CH3COOH+OH-右移 >
(2)①=②>③ (3)碱 > 酸 < (4)中 < (5)=
解析

 名校课堂系列答案
名校课堂系列答案关于10mL0.1 mol.·L-1的NH3 ? H2O溶液,下列说法正确的是
| A.25°C时,若溶液的 pH=11,则 Kb(NH3 ? H2O) = 1X10-6 mol.L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中 的值变小 的值变小 |
| C.向溶液中加入10mL 0.1 mol.L-1HC1,所得溶液中离子浓度大小顺序为C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| D.向溶液中加入5mL0.1mol/LHC1,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
(16分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是 (用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 。
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
 )>c(SO
)>c(SO )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .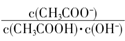 不变
不变 减小
减小

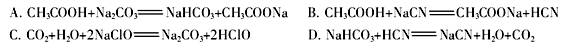

 离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。