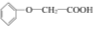
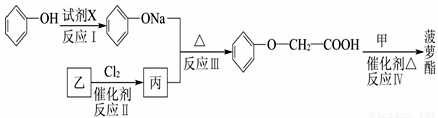
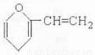
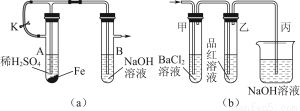
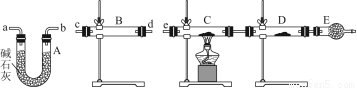
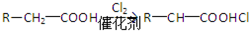题目内容
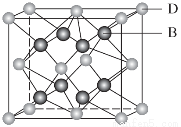
有A、B、C、D、E、F 6种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有3个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。
请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)F的氧化物FO3分子的空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________________________________________。
与其最简单分子互为等电子体的阳离子为________。
(4)下列分子结构图中的“ ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
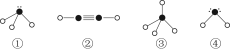
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填写序号);在②的分子中有________个σ键和________个π键。
(5)从图中可以看出,D与B形成的离子化合物的化学式为________。
(6)图中,若D与B的离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________________________________________________________________(写出表达式即可)。
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)平面正三角形
(3)与水分子间形成氢键 H3O+
(4)①③④ 3 2
(5)CaF2
(6)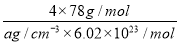
【解析】由题意可知,A为氢元素,B为氟元素,C为氮元素,F为硫元素;E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,为铜元素;D是主族元素且与铜元素同周期,并且D与氟元素形成的离子化合物的晶胞中含有8个F原子和8×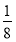 +6×
+6×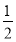 =4个D原子,可知其化学式为DF2,D的化合价为+2价,为钙元素。(1)当d轨道全充满或半充满时能量较低,状态较稳定。(2)SO3分子中硫原子形成三个σ键,不含孤电子对,则杂化轨道数为 3,空间构型为平面正三角形。(3)NH3分子和H2O分子可以形成分子间氢键,所以NH3易溶于水;等电子体是原子数相同,价电子数相同的微粒。NH3分子中含有10个电子,与其互为等电子体的阳离子为H3O+。(4)中心原子杂化轨道数=σ键个数+孤电子对数,单键为σ键,双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。由图可知,①所示分子的中心原子中含有3个σ 键和1个孤电子对,杂化轨道数为4,采取sp3杂化,②所示分子的中心原子中含有2个σ 键和0个孤电子对,杂化轨道数为2,采取sp杂化;③所示分子的中心原子中含有4个σ 键和0个孤电子对,杂化轨道数为4,采取sp3杂化;④所示分子的中心原子中含有2个σ 键和2个孤电子对,杂化轨道数为4,采取sp3杂化。(6)根据晶胞结构可以知道一个CaF2晶胞中有4个Ca2+和8个F-,CaF2的摩尔质量为78 g·mol-1,一个晶胞的质量为
=4个D原子,可知其化学式为DF2,D的化合价为+2价,为钙元素。(1)当d轨道全充满或半充满时能量较低,状态较稳定。(2)SO3分子中硫原子形成三个σ键,不含孤电子对,则杂化轨道数为 3,空间构型为平面正三角形。(3)NH3分子和H2O分子可以形成分子间氢键,所以NH3易溶于水;等电子体是原子数相同,价电子数相同的微粒。NH3分子中含有10个电子,与其互为等电子体的阳离子为H3O+。(4)中心原子杂化轨道数=σ键个数+孤电子对数,单键为σ键,双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。由图可知,①所示分子的中心原子中含有3个σ 键和1个孤电子对,杂化轨道数为4,采取sp3杂化,②所示分子的中心原子中含有2个σ 键和0个孤电子对,杂化轨道数为2,采取sp杂化;③所示分子的中心原子中含有4个σ 键和0个孤电子对,杂化轨道数为4,采取sp3杂化;④所示分子的中心原子中含有2个σ 键和2个孤电子对,杂化轨道数为4,采取sp3杂化。(6)根据晶胞结构可以知道一个CaF2晶胞中有4个Ca2+和8个F-,CaF2的摩尔质量为78 g·mol-1,一个晶胞的质量为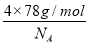 ,则晶胞的体积为
,则晶胞的体积为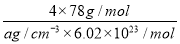 。
。

 优加精卷系列答案
优加精卷系列答案碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)已知:C(s)+CO2(g) 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)__________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
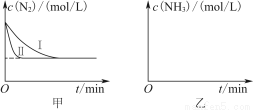
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO3—、SO42—、CO32—、HCO3—、MnO4—。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+。
将该白色粉末进行下列实验,观察到的现象如下:
实验操作 | 现象 |
a.取少量粉末,加水、振荡 | 全部溶解、 |
溶液无色透明 |
|
b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
c.取少量粉末,加盐酸 | 无明显现象 |
d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有______________(填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有_____________________________________。
(3)从c实验中,可推断粉末中不可能有________________________________。
(4)从d实验中,可推断粉末中不可能有________,一定含有________。
(5)以上各实验仍无法确定是否存在的离子是____________。