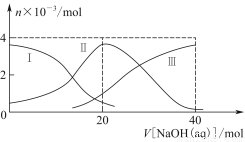
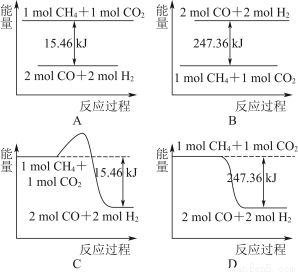
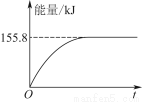
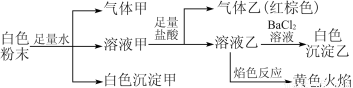
题目内容
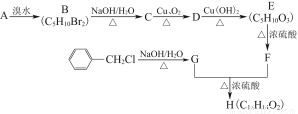
菠萝酯是一种食用香料,是化合物甲与苯氧乙酸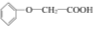 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是 。
(2)5.8 g甲完全燃烧产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 。
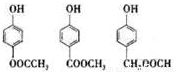
(3)苯氧乙酸有多种酯类的同分异构体,写出其中能与FeCl3溶液发生显色反应,且苯环上只有两种一硝基取代物的所有可能的同分异构体的结构简式:
。
(4)已知:
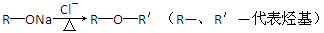
菠萝酯的合成路线如下:
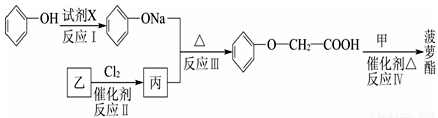
①试剂X不能选用的是(选填字母) 。
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是 ,反应Ⅱ的反应类型是 。
③反应Ⅳ的化学方程式是 。
(1)羟基
(2)CH2=CH—CH2—OH
(3)
(4)①ac
②ClCH2COOH 取代反应
③
【解析】(1)酯化反应是羧基和羟基之间的反应。(2)对气体来说,相同条件下密度之比等于相对分子质量之比,甲蒸气对氢气的密度之比是29,可知甲的相对分子质量为58,则5.8 g甲的物质的量为0.1 mol,完全燃烧产生0.3 mol CO2和0.3 mol H2O,可知甲分子中含有3个C和6个H,可知其分子式为C3H6O;甲分子中含有—OH,不含—CH3且为链状结构,则其结构简式为CH2=CHCH2OH。(3)根据题意,同分异构体中含有酚羟基,属于酯,且其一硝基取代物为两种,则必还有一个取代基,且为对位结构,为

(4)①CH3COOH和H2CO3酸性都比OH强;②由题目所给物质转化的信息可知丙为ClCH2COOH,反应Ⅱ本质为Cl取代了乙分子中的H;③酯化反应为可逆反应,应用“ ”而不能用“=”。
”而不能用“=”。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
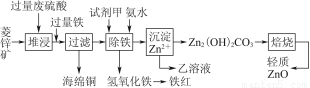
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。