题目内容
20.化合物HIn在水溶液中存在以下电离平衡:HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
故可用于作酸碱指示剂,现有浓度均为0.02mol/L的下列溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是( )
| A. | ①④ | B. | ①④⑤ | C. | ②⑥ | D. | ②⑤⑥ |
分析 能使指示剂显红色,应使c(HIn)>c(In-),所加入物质应使平衡向逆反应方向移动,所加入溶液应呈酸性,以此解答该题.
解答 解:能使指示剂显红色,应使c(HIn)>c(In-),所加入物质应使平衡向逆反应方向移动,所加入溶液应呈酸性,①④为酸性溶液,可使平衡向逆反应方向移动,而②⑤溶液呈碱性,可使平衡向正反应方向移动,③为中性溶液,平衡不移动,
故选A.
点评 本题考查化学平衡的影响因素,题目难度不大,注意根据颜色的变化判断平衡移动的移动方向,结合外界条件对平衡移动的影响分析.

练习册系列答案
相关题目
10.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5mol•L-1的所有一元酸中氢离子浓度都是0.5mol•L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5mol•L-1的所有一元酸中氢离子浓度都是0.5mol•L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②③④⑤ | C. | 只有⑤ | D. | 只有⑥ |
11.关于卤素的下列叙述正确的是( )
| A. | 卤素是典型的非金属元素,因此不能与其他非属元素化合 | |
| B. | 同周期中卤族元素的电负性最小 | |
| C. | 卤素各单质都能和水剧烈反应 | |
| D. | 卤素单质都能和H2反应,且气态氢化物的稳性随单质氧化性的增强而增强 |
8.下列说法正确的是( )
| A. | AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热煮沸的方法可除去KNO3溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
5. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
12.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯(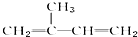 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
9.下列有关NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
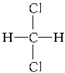 与
与 之间的关系是同种物质(填“同种物质”或“同分异构体”).
之间的关系是同种物质(填“同种物质”或“同分异构体”).