题目内容
某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式。
第一阶段的反应:CuCl2 Cu+Cl2↑
Cu+Cl2↑
第二阶段的反应:2H2O 2H2↑+O2↑
2H2↑+O2↑
 Cu+Cl2↑
Cu+Cl2↑第二阶段的反应:2H2O
 2H2↑+O2↑
2H2↑+O2↑该溶液由Cu(NO3)2、MgCl2和H2O三种物质组成,其中含有H+、Cu2+、Mg2+三种阳离子和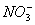 、Cl-、OH-三种阴离子。H+、Cu2+、Mg2+在阴极上放电的先后顺序是Cu2+>H+>Mg2+,
、Cl-、OH-三种阴离子。H+、Cu2+、Mg2+在阴极上放电的先后顺序是Cu2+>H+>Mg2+,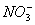 、Cl-、OH-在阳极上放电的先后顺序是Cl->OH->
、Cl-、OH-在阳极上放电的先后顺序是Cl->OH->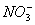 。溶液中的OH-和H+均来自难电离的H2O。电极反应式为:
。溶液中的OH-和H+均来自难电离的H2O。电极反应式为:
第一阶段 阳极:2Cl--2e- Cl2↑
Cl2↑
阴极:Cu2++2e-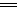 Cu
Cu
第二阶段 阳极:2H2O-4e-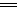 O2↑+4H+
O2↑+4H+
阴极:4H2O+4e-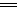 2H2↑+4OH-
2H2↑+4OH-
将电极反应式合并得电解反应的化学方程式。
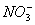 、Cl-、OH-三种阴离子。H+、Cu2+、Mg2+在阴极上放电的先后顺序是Cu2+>H+>Mg2+,
、Cl-、OH-三种阴离子。H+、Cu2+、Mg2+在阴极上放电的先后顺序是Cu2+>H+>Mg2+,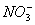 、Cl-、OH-在阳极上放电的先后顺序是Cl->OH->
、Cl-、OH-在阳极上放电的先后顺序是Cl->OH->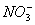 。溶液中的OH-和H+均来自难电离的H2O。电极反应式为:
。溶液中的OH-和H+均来自难电离的H2O。电极反应式为:第一阶段 阳极:2Cl--2e-
 Cl2↑
Cl2↑阴极:Cu2++2e-
 Cu
Cu第二阶段 阳极:2H2O-4e-
 O2↑+4H+
O2↑+4H+阴极:4H2O+4e-
 2H2↑+4OH-
2H2↑+4OH-将电极反应式合并得电解反应的化学方程式。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Zn+Ag2O+H2O
Zn+Ag2O+H2O Zn(OH)2
Zn(OH)2 液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 R—R + H2↑+ 2CO2+ 2KOH(R—代表烃基)。关于无机产物,下列说法正确的是( )
R—R + H2↑+ 2CO2+ 2KOH(R—代表烃基)。关于无机产物,下列说法正确的是( )