题目内容
在500 g CuSO4溶液中插入两根电极,一根为铁,一根为含杂质锌均匀的粗铜。通电一段时间后切断电源,立即将电极取出,这时铁极上析出7.04 g铜,电解质溶液增重0.02 g。求粗铜中含锌的质量分数。
18.4%
铁上有Cu析出,说明铁为阴极,粗铜为阳极。
阴极:Cu2++2e-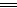 Cu
Cu
阳极:Cu-2e-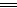 Cu2+ Zn-2e-
Cu2+ Zn-2e-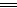 Zn2+
Zn2+
因溶液增重0.02 g,则:
Zn — Cu Δw
65g 64g 1g
1.3g 1.28g 0.02g
可知溶解的粗铜中含Zn1.3g,含Cu7.04g-1.28g=5.76g,所以
w(Zn)=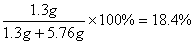 。
。
阴极:Cu2++2e-
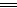 Cu
Cu阳极:Cu-2e-
 Cu2+ Zn-2e-
Cu2+ Zn-2e- Zn2+
Zn2+因溶液增重0.02 g,则:
Zn — Cu Δw
65g 64g 1g
1.3g 1.28g 0.02g
可知溶解的粗铜中含Zn1.3g,含Cu7.04g-1.28g=5.76g,所以
w(Zn)=
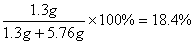 。
。
练习册系列答案
相关题目