题目内容
下列叙述中,正确的是
| A.在船舶的外壳装上铜块可防止其发生电化学腐蚀 |
| B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 |
C.FeCl3溶 液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
B
A:在船舶的外壳装上铜块是加快了船体的腐蚀,因为船体是铁,与铜形成原电池时铁做负极,腐蚀更快,为防止其发生电化学腐蚀可加一块比铁活泼的金属,如锌,船体做正极,就被保护了。C:FeCl3溶液溶液加热蒸干、灼烧得到Fe2O3,因为FeCl3水解得到HCl,挥发了,促进水解的进行。Fe2(SO4)3溶液加热蒸干时,水解产物是硫酸,无挥发性,最后产物还是Fe2(SO4)3。
D:用惰性电极分别电解CuCl2溶液时,得到单质Cu,电解MgCl2溶液时,得不到单质Mg,因为氧化性H+>Mg2+,H+先放电,得到H2。
D:用惰性电极分别电解CuCl2溶液时,得到单质Cu,电解MgCl2溶液时,得不到单质Mg,因为氧化性H+>Mg2+,H+先放电,得到H2。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 阴极:2H3O++2e-→H2↑+2H2O
阴极:2H3O++2e-→H2↑+2H2O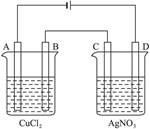
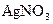 溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是