题目内容
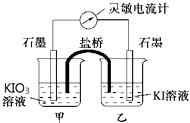
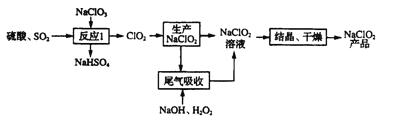
【题目】如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1 , 一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题: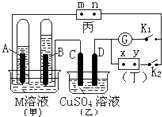
(1)M溶液可能是(填序号).
A.KCl溶液
B.Ba(OH)2溶液
C.KNO3溶液
D.CuCl2溶液
(2)乙池中盛有足量的硫酸铜溶液,D电极上的电极反应式为 , 此时向溶液中加入可以使溶液完全复原.
(3)滤纸丙上m点附近变为色,n点附近变为色,
(4)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1 , 断开K2 , 发现电流计G指针发生偏转,若M为硫酸溶液,写出B电极上发生的反应式 .
【答案】
(1)BC
(2)2H2O﹣4e﹣=4H++O2↑;0.16克CuO
(3)蓝;红
(4)O2+4e﹣+4H+=2H2O
【解析】解:A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml,A、B两极产生的气体体积之比为2:1,则A电极上生成氢气,B电极上生成氧气,所以A为阴极,B为阳极,x为正极,y为负极,(1)电解KNO3溶液、Ba(OH)2溶液溶液实际上是电解水,电解氯化钾溶液是电解氯化钾和水,电解氯化铜溶液生成氯气和铜,所以只有BC符合;所以答案是:BC;(2)D为阳极,发生氧化反应,电极方程式为2H2O﹣4e﹣=4H++O2↑,乙反应的化学方程式为2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,B极产生的气体体积为22.4mL,则n(O2)=0.001mol,转移0.004mol电子,由方程式可知生成0.001mol氧气,0.002mol铜,即生成0.002molCuO,应加入m(CuO)=0.001mol×80g/mol=0.16g, 所以答案是:2H2O﹣4e﹣=4H++O2↑;0.16克CuO;(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,所以m端滤纸变蓝,n为阴极,发生还原反应生成氢气和KOH,滴加酚酞溶液变红色,所以答案是:蓝;红;(4)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e﹣+4H+=2H2O,所以答案是:O2+4e﹣+4H+=2H2O.
2Cu+2H2SO4+O2↑,B极产生的气体体积为22.4mL,则n(O2)=0.001mol,转移0.004mol电子,由方程式可知生成0.001mol氧气,0.002mol铜,即生成0.002molCuO,应加入m(CuO)=0.001mol×80g/mol=0.16g, 所以答案是:2H2O﹣4e﹣=4H++O2↑;0.16克CuO;(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,所以m端滤纸变蓝,n为阴极,发生还原反应生成氢气和KOH,滴加酚酞溶液变红色,所以答案是:蓝;红;(4)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e﹣+4H+=2H2O,所以答案是:O2+4e﹣+4H+=2H2O.

【题目】酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
(1)酸性锌锰干电池的负极反应为
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zng.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:①加入足量稀硫酸和溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为到之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.