题目内容
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH﹣):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3﹣、CO32﹣ , 现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( ) 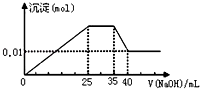
A.原溶液一定不存在H+、Cu2+、CO ![]()
B.不能确定原溶液是否含有K+、NO ![]()
C.原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D.实验所加的NaOH溶液浓度为2mol/L
【答案】B
【解析】解:无色溶液,不含铜离子,逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH﹣时无沉淀生成,有NH4+ , NH4++OH﹣=NH3H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+ , 镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,
A、原溶液一定不存在H+、Cu2+、CO ![]() ,故A正确;
,故A正确;
B、不含碳酸根离子,根据溶液呈电中性,所以一定含硝酸根离子,故B错误;
C、根据图象知,35﹣40mL时Al(OH)3和NaOH反应生成NaAlO2 , 则0﹣25mL时NaOH和Mg2+、Al3+反应生成沉淀,生成NaAlO2时需要NaOH5mL,则生成Al(OH)3需要NaOH 15mL,则有10mLNaOH溶液和镁离子反应,25﹣35mL时氢氧化钠溶液和NH+4反应生成氨水,根据使用NaOH溶液体积知,n(Mg2+):n(Al3+):n(NH+4)=1:1:2,故C正确;
D、当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2 , n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)= ![]() =0.1mol/L,生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=
=0.1mol/L,生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)= ![]() =2mol/L,故D正确;
=2mol/L,故D正确;
故选B.
无色溶液,不含铜离子,逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH﹣时无沉淀生成,有NH4+ , NH4++OH﹣=NH3H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+ , 镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,由此分析解答.