��Ŀ����
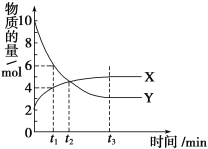
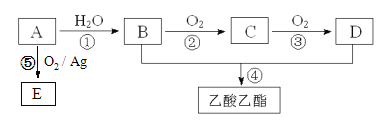
����Ŀ����ҵ����AΪ��Ҫԭ�����ϳ�������������ϳ�·������ͼ��ʾ������A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����֪2CH3CHO+O2![]() 2CH3COOH����ش��������⣺
2CH3COOH����ش��������⣺
��1��д��A�ĵ���ʽ________________________��
��2��B��D�����ں��еĹ����ŷֱ���________��________�������ƣ���
��3��д�����з�Ӧ�ķ�Ӧ���ͣ���______________����______________��
��4��д���ڷ�Ӧ�Ļ�ѧ����ʽ�� _______________________��
��5��E��C��ͬ���칹�壬��ṹ��ʽΪ___________����ͳ����E�ķ������ȴ��Ҵ�����������2-���Ҵ�������Ca(OH)2��Ӧ�Ƶá��봫ͳ������Ȳ��÷�Ӧ�ݵ���������_________________��
���𰸡�![]() �ǻ��Ȼ��ӳɷ�Ӧȡ����Ӧ����������Ӧ���֣�
�ǻ��Ȼ��ӳɷ�Ӧȡ����Ӧ����������Ӧ���֣�![]()
![]() ԭ��������Ϊ100%
ԭ��������Ϊ100%
��������
A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����AΪCH2=CH2����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����BΪ�Ҵ���B��D��Ӧ����������������DΪ���ᣬCΪ��ȩ��
��1��A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����AΪCH2=CH2��������̼ԭ����̼ԭ��ͨ�����Թ��õ��Ӷ������ӣ�̼ԭ������ԭ��ͨ��һ�Թ��õ��Ӷ������ӣ����Ե���ʽΪ![]() ��
��
��2��BΪCH3CH2OH��DΪCH3COOH����B�й��������ǻ���D�й��������Ȼ���
��3����һ�������£���ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����Ũ���������������������£��Ҵ������ᷢ��������Ӧ����ȡ����Ӧ����������������
��4����ͭ���������������������£��Ҵ�����������������ȩ����Ӧ����ʽΪ��![]() ��
��
��5��E��C��ͬ���칹��������ʽ��ͬ���ṹ��ͬ����E�Ľṹ��ʽΪ��![]() ����ͳ����E�ķ������ȴ��Ҵ�����������2-���Ҵ�������Ca(OH)2��Ӧ�Ƶã���Ӧ���ղ����
����ͳ����E�ķ������ȴ��Ҵ�����������2-���Ҵ�������Ca(OH)2��Ӧ�Ƶã���Ӧ���ղ����![]() �⣬�����Ȼ��ƣ���ʹ�÷�Ӧ���Ʊ�
�⣬�����Ȼ��ƣ���ʹ�÷�Ӧ���Ʊ�![]() ��û���������ԭ��������Ϊ100%��
��û���������ԭ��������Ϊ100%��

 ��У����ϵ�д�
��У����ϵ�д�