题目内容
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
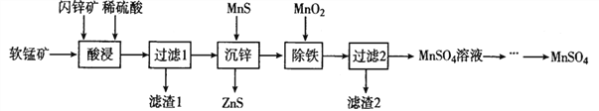
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
【答案】催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O 1.25×109 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Fe(OH)3 ZnS
【解析】
(1)因为软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS),加稀硫酸会把这些金属氧化物变成离子, “酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是催化剂的作用,因为催化剂能够改变化学反应的速。MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。本题答案:催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
Ksp(MnS)=c(c(Mn2+). c(S2-), Ksp(MnS)/ Ksp(MnS)= c(Mn2+)/c(Zn2+)=K所以K=1.25×109
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(4)由(3)知强酸性条件下加入MnO2氧化Fe2+ 变成Fe3+ ,, Ksp(Fe(OH)3)=2.6![]() 10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
(5)由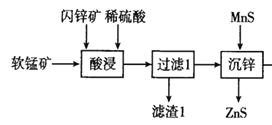 知该工艺流程中可以循环利用的物质是ZnS。
知该工艺流程中可以循环利用的物质是ZnS。

 阅读快车系列答案
阅读快车系列答案【题目】I、下图是全钒液流电池的示意图
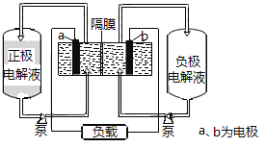
该电池充放电的总反应式为:![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。
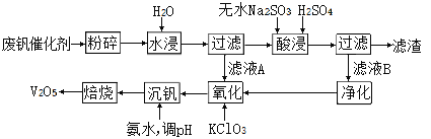
(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。