题目内容
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为___________, 其中氮的化合价为___________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为____________.
(3)①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4=______________, 联氨和N2O4可作为火箭推进剂的主要原因为______________________.
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为_____ (已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为_______________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______________. 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2__________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________________________.
【答案】![]() -2 NaClO+2NH3=N2H4+NaCl+H2O 2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体 8.7×10-7 N2H6(HSO4)2 固体逐渐变黑,并有气泡产生 1 N2H4的用量少,不产生其他杂质(还原产物为N2和H2O,而Na2SO3产生Na2SO4)
-2 NaClO+2NH3=N2H4+NaCl+H2O 2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体 8.7×10-7 N2H6(HSO4)2 固体逐渐变黑,并有气泡产生 1 N2H4的用量少,不产生其他杂质(还原产物为N2和H2O,而Na2SO3产生Na2SO4)
【解析】
(1)N2H4是氮原子和氢原子形成四个共价键,氮原子和氮原子间形成一个共价键形成的共价化合物,元素化合价代数和为0计算化合价;
(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠;
(3) ①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
根据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O![]() N2H5++OH-,其平衡常数K1=
N2H5++OH-,其平衡常数K1=![]() ,由已知N2H4+H+N2H5+的平衡常数K=
,由已知N2H4+H+N2H5+的平衡常数K=![]() =8.7×107,Kw=c(H+)C(OH-)=1.0×10-14,因此有K1=K
=8.7×107,Kw=c(H+)C(OH-)=1.0×10-14,因此有K1=K![]() Kw=8.7×10-7;
Kw=8.7×10-7;
由于是二元碱,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;
(5)联胺被银离子氧化,银离子被还原生成单质银,联胺被氧化失电子N2H4~N2-4e-,O2~4e-,依据守恒计算判断,依据锅炉的质地以及反应产物性质解答。
(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为:![]() ,其中氢元素化合价为+1价,则氮元素化合价为-2价,
,其中氢元素化合价为+1价,则氮元素化合价为-2价,
因此,本题正确答案是:![]() ;-2;
;-2;
(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠,结合原子守恒配平书写反应的化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O,
因此,本题正确答案是:NaClO+2NH3=N2H4+NaCl+H2O;
(3①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
根据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4= 2ΔH3-2ΔH2-ΔH1;
根据反应④可以知道,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,
因此,本题正确答案是:2ΔH3-2ΔH2-ΔH1;反应放热量大,产生大量气体;
(4)由题意知联氨第一步电离反应为N2H4+H2O![]() N2H5++OH-,其平衡常数K1=
N2H5++OH-,其平衡常数K1=![]() ,由已知N2H4+H+N2H5+的平衡常数K=
,由已知N2H4+H+N2H5+的平衡常数K=![]() =8.7×107,Kw=c(H+)C(OH-)=1.0×10-14,因此有K1=K
=8.7×107,Kw=c(H+)C(OH-)=1.0×10-14,因此有K1=K![]() Kw=8.7×10-7。
Kw=8.7×10-7。
由于是二元碱,因此联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2;
因此,本题正确答案是:8.7×10-7 ;N2H6(HSO4)2;
(5)联氨能够将AgBr还原为单质Ag,自身被氧化为N2,还原出来的单质银因为颗粒较小因此呈黑色附着在AgBr上,所以观察到的实验现象为固体逐渐变黑,并有气泡产生;
联氨被氧气氧化的方程式为N2H4+O2=N2+2H2O,可知一分子联氨消耗一分子氧气,而二者摩尔质量相同,因此1kg联氨可除去1kg溶解的氧气;
使用Na2SO3处理水中溶解的氧气时自身会被氧化成Na2SO4,从而带来新的杂质,而联氨的还原产物为N2和水,且用量要小于Na2SO3,因此联氨的优点是N2H4的用量少,不产生其他杂质。
因此,本题正确答案是:固体逐渐变黑,并有气泡产生;1 ;N2H4的用量少,不产生其他杂质(还原产物为N2和H2O,而Na2SO3产生Na2SO4)。

 阅读快车系列答案
阅读快车系列答案【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
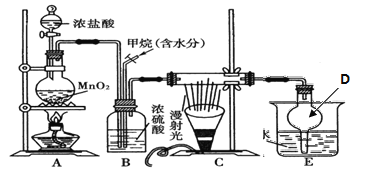
(1)电解处理法:
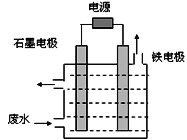
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
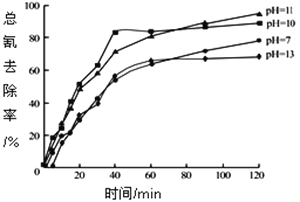
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。