题目内容
【题目】已知下列反应:
①![]() ;ΔH=
;ΔH=![]() 196.6kJmol-1
196.6kJmol-1
②![]() ;ΔH<0
;ΔH<0
③![]() ;ΔH=
;ΔH=![]() 92.4 kJmol-1
92.4 kJmol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量_________(填“<”“>”“=”)98.3kJ;理由是_____________________;
(2)反应②的化学平衡常数表达式K=___________,温度降低时,K值_______(填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率=___________;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有____________________。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
【答案】<可逆反应不能进行到底![]() 增大50%BD
增大50%BD
【解析】
(1)根据反应:①2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=
2SO3(g) ΔH=![]() 196.6kJmol-1可知,生成1molSO3放出热量98.3kJ;由于可逆反应不能进行到底,故在一定条件下向一密闭容器中充入1mol SO2和0.5molO2,充分反应后,放出热量<98.3kJ;综上所述,本题答案是:<;可逆反应不能进行到底。
196.6kJmol-1可知,生成1molSO3放出热量98.3kJ;由于可逆反应不能进行到底,故在一定条件下向一密闭容器中充入1mol SO2和0.5molO2,充分反应后,放出热量<98.3kJ;综上所述,本题答案是:<;可逆反应不能进行到底。
② 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O ΔH<0的化学平衡常数表达式K=c4(NO)c6(H2O)/c4(NH3)c5(O2);该反应为放热反应,温度降低时,平衡正向移动,K值增大;综上所述,本题答案是:c4(NO)c6(H2O)/c4(NH3)c5(O2); 增大。
4NO(g)+6H2O ΔH<0的化学平衡常数表达式K=c4(NO)c6(H2O)/c4(NH3)c5(O2);该反应为放热反应,温度降低时,平衡正向移动,K值增大;综上所述,本题答案是:c4(NO)c6(H2O)/c4(NH3)c5(O2); 增大。
(3)设平衡时氨气的转化率为x,则
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始量 1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
平衡混合气的总物质的量为3mol,则1-x+3-3x+2x=3,x=0.5,则平衡时氮气的转化率=0.5/1×100%=50%;综上所述,本题答案是:50%。
(4)为有效提高氢气的转化率,可采取的措施有:A.反应是放热反应,升温平衡左移,氢气的转化率降低,不符合;B.增大压强,平衡向气体体积减小的方向移动,即向右移动,氢气的转化率增大,符合;C.减小压强,平衡向气体体积增大的方向移动,即向左移动,氢气的转化率减小,不符合; D.及时移出氨,平衡右移, 氢气的转化率增大,符合;E.循环利用和不断补充氢气,增大了氮气的转化率但是降低了氢气的转化率,不符合;综上所述,本题答案是:BD。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
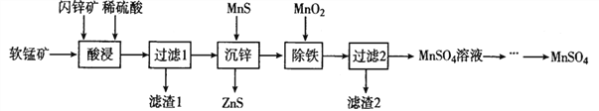
小博士期末闯关100分系列答案【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
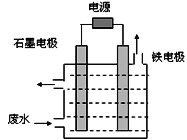
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
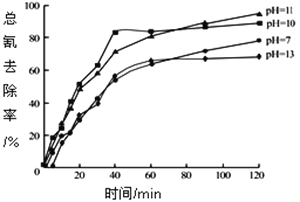
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。
【题目】二氧化氯(ClO2)常用于处理含硫废水。某学习小组在实验室中探究ClO2与Na2S的反应。
已知:① ClO2是极易溶于水的黄绿色气体,有毒,沸点为11℃。
② SO2 + NaClO3 + H2SO4→ ClO2 + NaHSO4(未配平)
③ ClO2 + NaOH→NaCl + NaClO3 + H2O(未配平)
请回答下列问题:
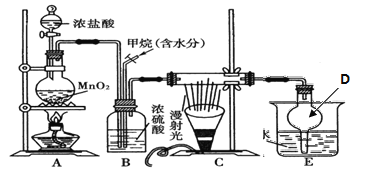
(1)设计如下装置制备ClO2

①装置A中反应的化学方程式为__________________________________。
②装置B中反应的氧化剂与还原剂的物质的量之比为___________。
③欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→g→h→_________________→d。
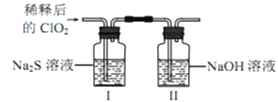
(2)探究ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液放入试管甲中,滴加品红溶液和盐酸。 | 品红溶液始终不褪色 | ①无_______生成。 |
另取少量Ⅰ中溶液放入试管乙中,加入Ba(OH)2溶液和盐酸,振荡。 | ②___________ | 有SO42-生成 |
③继续在试管乙中加入Ba(OH)2溶液至过量,静置,取上层清液放入试管丙中,______________。 | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为_________________________________________。用于处理含硫废水时,ClO2相对于Cl2的优点是_____________________________________________(任写一条)。