题目内容
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族;锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。
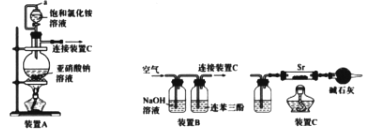
I.利用装置A和C制备Sr3N2
(1)写出由装置A制备N2的化学方程式_______。
(2)装置A中a导管的作用是_______。利用该套装置时,应先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,理由是__________。
II.利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(3)写出装置B的NaOH溶液中发生反应的离子方程式_________。
(4)装置C中广口瓶盛放的试剂是_________。
III.测定Sr3N2产品的纯度
(5)取ag该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是____。经改进后测得浓硫酸增重bg,则产品的纯度为_____(用相关字母的代数式表示)。
【答案】NH4Cl+NaNO2![]() N2↑+NaCl+2H2O 平衡气压,使液体顺利流下 利用生成的N2将装置内空气排尽 CO2+2OH-= CO32-+H2O 浓硫酸 未将气体中的水蒸气除去,也被浓硫酸吸收引起增重(或其他合理答案)
N2↑+NaCl+2H2O 平衡气压,使液体顺利流下 利用生成的N2将装置内空气排尽 CO2+2OH-= CO32-+H2O 浓硫酸 未将气体中的水蒸气除去,也被浓硫酸吸收引起增重(或其他合理答案) ![]() %
%
【解析】
I.利用装置A和C制备Sr3N2,装置A中NaNO2和NH4Cl反应制备N2,由于N2中混有H2O(g),为防止氮化锶遇水剧烈反应,故N2与Sr反应前必须干燥,装置 C中广口瓶用于除去N2中的H2O(g),碱石灰的作用是防止外界空气进入硬质玻璃管中。
II. 利用装置B和C制备Sr3N2,锶与镁位于同主族,联想Mg的性质,空气中的CO2、O2等也能与锶反应,为防止锶与CO2、O2反应,则装置B中NaOH用于吸收CO2,连苯三酚吸收O2,装置C中广口瓶用于除去N2中的H2O(g),碱石灰的作用是防止外界空气进入硬质玻璃管中。
III. 测定Sr3N2产品的纯度的原理为:Sr3N2+6H2O=3Sr(OH)2+2NH3↑、2NH3+H2SO4=(NH4)2SO4,根据浓硫酸增加的质量和浓硫酸的性质分析计算。
I.利用装置A和C制备Sr3N2
(1)NaNO2和NH4Cl反应制备N2,根据原子守恒还有NaCl、H2O生成,反应的化学方程式为NH4Cl+NaNO2![]() N2↑+NaCl+2H2O。
N2↑+NaCl+2H2O。
(2)装置A中a导管将分液漏斗上下相连,其作用是平衡气压,使液体顺利流下;锶与镁位于同主族,联想Mg的性质,空气中的CO2、O2等也能与锶反应,为防止装置中空气对产品纯度的影响,应先点燃装置A的酒精灯一段时间,利用生成的N2将装置内空气排尽,再点燃装置C的酒精灯。
II. 利用装置B和C制备Sr3N2
(3)锶与镁位于同主族,联想Mg的性质,空气中的CO2、O2等也能与锶反应,为防止锶与CO2、O2反应,则装置B中NaOH用于吸收CO2,反应的离子方程式为CO2+2OH-=CO32-+H2O。
(4)为防止氮化锶遇水剧烈反应,故N2与Sr反应前必须干燥,装置 C中广口瓶用于除去N2中的H2O(g),其中盛放的试剂为浓硫酸。
III.测定Sr3N2产品的纯度的原理为:Sr3N2+6H2O=3Sr(OH)2+2NH3↑、2NH3+H2SO4=(NH4)2SO4,故浓硫酸增加的质量为NH3的质量,由于浓硫酸具有吸水性,会将NH3中的水蒸气一并吸收,导致NH3的质量偏高,从而导致测得的产品纯度偏高。经改进后测得浓硫酸增重bg,根据N守恒,n(Sr3N2)=![]() n(NH3)=
n(NH3)=![]() ×
×![]() =
=![]() mol,则m(Sr3N2)=
mol,则m(Sr3N2)=![]() mol×292g/mol=
mol×292g/mol=![]() g,产品的纯度为
g,产品的纯度为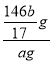 ×100%=
×100%=![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案