题目内容
【题目】t ℃时,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M2+),p(CO32-)=-lg c(CO32-)。ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A.线b表示BCO3的溶解平衡曲线
B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C.t ℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=10 0.9
BCO3(s)+A2+(aq)平衡常数K=10 0.9
D.向0.1 L 1 mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6 g时,B2+离子恰好沉淀完全(当B2+离子浓度为10-5 mol/L时认为沉淀完全)
【答案】D
【解析】
A. ACO3比BCO3溶解度更大,则ACO3的溶度积大于BCO3的溶度积,由图可知a的溶度积小于b的溶度积,所以线a表示BCO3的沉淀溶解平衡曲线,线b表示ACO3的沉淀溶解平衡曲线,A错误;
B. 在ACO3的饱和溶液中存在溶解平衡:ACO3(s)![]() A2+(aq)+CO32-(aq),加入Na2CO3溶液,溶液的体积增大,c(A2+)减小,c(CO32-)增大,c(A2+)·c(CO32-)不一定大于Ksp(ACO3),因此不一定产生沉淀,B错误;
A2+(aq)+CO32-(aq),加入Na2CO3溶液,溶液的体积增大,c(A2+)减小,c(CO32-)增大,c(A2+)·c(CO32-)不一定大于Ksp(ACO3),因此不一定产生沉淀,B错误;
C. 由选项A分析可知线a表示BCO3的沉淀溶解平衡曲线,线b表示ACO3的沉淀溶解平衡曲线,当pM=0时,p(CO32-)=2.2,则Ksp(ACO3)= c(A2+)·c(CO32-)=10-2.2,同理可知Ksp(BCO3)= c(B2+)·c(CO32-)=10-4,t℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=
BCO3(s)+A2+(aq)平衡常数K=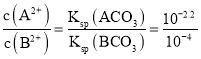 =101.8,C错误;
=101.8,C错误;
D. 由曲线a可知Ksp(BCO3)=c(B2+)·c(CO32-)=10-4,n(BCl2)=1 mol/L×0.1 L=0.1 mol,n(Na2CO3)=![]() =1.1 mol,二者按1:1反应产生BCO3沉淀后Na2CO3过量,剩余CO32-的物质的量为1.1 mol-0.1 mol=1 mol,c(CO32-)=
=1.1 mol,二者按1:1反应产生BCO3沉淀后Na2CO3过量,剩余CO32-的物质的量为1.1 mol-0.1 mol=1 mol,c(CO32-)=![]() =10 mol/L,则根据溶度积常数可知此时溶液中c(B2+)=
=10 mol/L,则根据溶度积常数可知此时溶液中c(B2+)=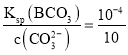 mol/L=10-5 mol/L,所以此时可认为B2+离子沉淀完全,D正确;
mol/L=10-5 mol/L,所以此时可认为B2+离子沉淀完全,D正确;
故答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。