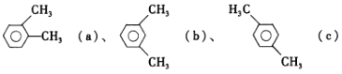
题目内容
【题目】常温下 ,向 20.00mL 0. 1molL-1 BOH溶液中 滴入 0. 1 mo lL-1 盐酸 ,溶液中由水电离出的 c ( H+ ) 的负对数 [ - l gc水( H+ ) ] 与所加盐酸体积的关系如下图所示,下列说法正确的是
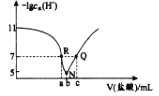
A.常温下,BOH的电离常数约为 1×10-4
B.N 点溶液离子浓度顺序:c(B+)>c(Cl-)> c( OH- )>c( H+)
C.a =20
D.溶液的pH: R > Q
【答案】D
【解析】
BOH对水的电离起抑制作用,加入盐酸发生反应BOH+HCl=BCl+H2O,随着盐酸的加入,BOH电离的OH-浓度减小,对水电离的抑制作用减弱,而且生成的BCl水解促进水的电离,水电离的H+浓度逐渐增大,两者恰好完全反应时水电离的H+浓度达到最大;继续加入盐酸,过量盐酸电离出H+又抑制水的电离,水电离的H+又逐渐减小,结合相应的点分析作答。
A.根据图象,起点时-lgc水( H+ )=11,c水( H+ )=10-11mol/L,即0.1mol/L的BOH溶液中水电离的H+浓度为10-11mol/L,碱溶液中H+全部来自水的电离,则0.1mol/L的BOH溶液中c( H+ )=10-11mol/L,溶液中c(OH-)=10-3mol/L,BOH的电离方程式为BOHB++OH-,BOH的电离平衡常数为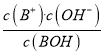 =
=![]() ≈10-5,A错误;
≈10-5,A错误;
B.N点-lgc水( H+ )最小,N点HCl与BOH恰好完全反应得到BCl溶液,由于B+水解溶液呈酸性,溶液中离子浓度由大到小的顺序为c(Cl-)>c(B+)>c( H+)> c( OH- ),B错误;
C.N点-lgc水( H+ )最小,N点HCl与BOH恰好完全反应得到BCl溶液,N点加入的盐酸的体积为20.00mL,则a<20.00mL,C错误;
D.N点-lgc水( H+ )最小,N点HCl与BOH恰好完全反应得到BCl溶液,R点加入的盐酸不足、得到BOH和BCl的混合液,Q点加入的盐酸过量、得到BCl和HCl的混合液,即R点加入的盐酸少于Q点加入的盐酸,Q点的酸性强于R点,则溶液的pH:R>Q,D正确;
答案选D。