题目内容
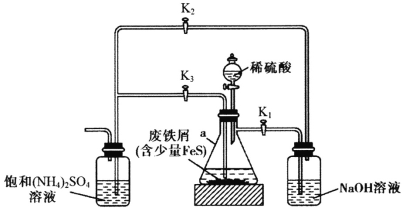
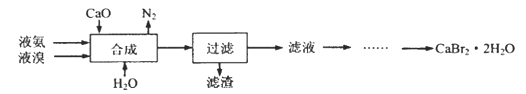
【题目】某校化学兴趣小组在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
实验步驟如下:

(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
①实验前,应进行的操作是________________________。三颈烧瓶内盛放有一定量的CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____________________。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是______________________________,装置C的作用可能是_______________。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是____________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,__________________,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取20.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是________________。
②KSCN的质量分数为______________________。
【答案】检查装置的气密性 防止发生倒吸现象 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 通过观察C中产生气泡的速率,控制加热的温度 NH4SCN+KOH
CaCl2+2NH3↑+2H2O 通过观察C中产生气泡的速率,控制加热的温度 NH4SCN+KOH![]() KSCN+NH3↑+H2O 过滤、洗涤、干燥 当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色 97%
KSCN+NH3↑+H2O 过滤、洗涤、干燥 当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色 97%
【解析】
(1)①实验前,应检查装置是否漏气。三颈烧瓶的下层CS2液体必须浸没导气管口,若不浸没导管口,则必然与水接触,从氨在水中的溶解程度进行分析。
②装置A是制取氨气的装置,药品为NH4Cl与Ca(OH)2。因这氨气不溶于CS2,反应缓慢,所以需缓慢通入,装置C的作用,从如何让氨气“缓慢”通入考虑。
(2)制备KSCN溶液:装置D中,NH4SCN与KOH反应,生成KSCN等。
(3)制备KSCN晶体:减压蒸发浓缩,冷却结晶,应将晶体从溶液中提取出来,然后再去除表面杂质,以获得硫氰化钾晶体。
(4) ①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,起初溶液为红色,后来变为无色,由此得出终点时的现象。
② 由反应SCN-+Ag+= AgSCN↓,可得出n(KSCN)=n(AgNO3),代入数据,便可求出KSCN的质量分数。
(1)①实验前,应进行的操作是检查装置的气密性。因为氨气极易溶于水,所以通氨气的导管口不能插入水层,从而得出三颈烧瓶的下层CS2液体必须浸没导气管口的原因是防止发生倒吸现象。答案为:检查装置的气密性;防止发生倒吸现象;
②装置A是制取氨气的装置,药品为NH4Cl与Ca(OH)2,发生反应的化学方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,因为氨气不溶于CS2,所以与CS2反应缓慢,应缓慢通气,从而得出装置C的作用可能是通过观察C中产生气泡的速率,控制加热的温度。答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,因为氨气不溶于CS2,所以与CS2反应缓慢,应缓慢通气,从而得出装置C的作用可能是通过观察C中产生气泡的速率,控制加热的温度。答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;通过观察C中产生气泡的速率,控制加热的温度;
CaCl2+2NH3↑+2H2O;通过观察C中产生气泡的速率,控制加热的温度;
(2)制备KSCN溶液:装置D中,NH4SCN与KOH反应,生成KSCN等,发生反应的方程为NH4SCN+KOH![]() KSCN+NH3↑+H2O。答案为:NH4SCN+KOH
KSCN+NH3↑+H2O。答案为:NH4SCN+KOH![]() KSCN+NH3↑+H2O;
KSCN+NH3↑+H2O;
(3)制备KSCN晶体:减压蒸发浓缩,冷却结晶,过滤、洗涤、干燥,以获得硫氰化钾晶体。答案为:过滤、洗涤、干燥;
(4) ①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色。答案为:当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色;
② 由反应SCN-+Ag+= AgSCN↓,可得出n(KSCN)=n(AgNO3)=0.1000mol/L×0.02L
=0.002mol,KSCN的质量分数为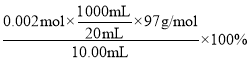 =97%。答案为:97%。
=97%。答案为:97%。

【题目】某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
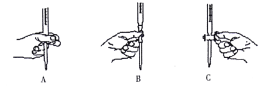
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。
(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数