题目内容
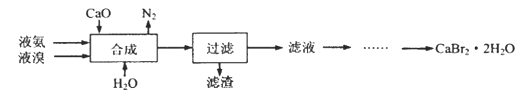
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
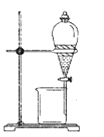
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
【答案】 将上层液体从上口倒入另一烧杯中 3CaO+3Br2+2NH3═3CaBr2+N2↑+3H2O 温度过高,Br2、NH3易挥发 确保Br2被充分还原 Ca(OH)2 用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥
【解析】 (1)用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是:使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,将上层液体从上口倒入另一烧杯中,故答案为:将上层液体从上口倒入另一烧杯中;
(2)根据流程图,“合成”过程中,氧化钙、液氨、液溴和水反应生成氮气、溴化钙等,反应的化学方程式为3CaO+3Br2+2NH3═3CaBr2+N2↑+3H2O;液溴和液氨容易挥发, “合成”温度应控制在70℃以下;投料时控制n(Br2):n(NH3)= 1:0.8,可以确保Br2被充分还原,故答案为:3CaO+3Br2+2NH3═3CaBr2+N2↑+3H2O;温度过高,Br2、NH3易挥发;确保Br2被充分还原;
(3)氧化钙与水反应生成的氢氧化钙微溶于水,因此“滤渣”的主要成分为Ca(OH)2,故答案为:Ca(OH)2;
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,二者能够在酸性条件下与溴离子反应生成溴,从而可以用活性炭吸附除去,在洗涤时可以用乙醇洗涤,减少溴化钙晶体的损失,也便与干燥。因此从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥,故答案为:用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,将滤液蒸发浓缩、冷却结晶、用砂芯漏斗过滤、用乙醇洗涤干净后,在真空干燥箱中干燥。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案