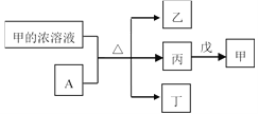
题目内容
【题目】已知NA为阿伏加德罗常数的值,下列叙述错误的有几个( )
①BF3、CCl4中所有原子均达到最外层8电子稳定结构
②46g SiO2中含有共价键的数目为NA
③2g H218O和D2O的混合物中,含有的电子数为NA
④K2SO4溶于水的过程中有离子键、共价键的断裂
⑤78g Na2O2中所含离子的数目为4NA
⑥18g D2O的中子数小于10NA
⑦1mol NH5中含有5NA个N—H键(已知NH5中所有原子都达到稀有气体的稳定结构)
A.3B.4C.5D.6
【答案】C
【解析】
①BF3中B原子最外层只有6个电子,①错误;
②SiO2由原子构成,1mol SiO2中平均含4mol Si-O键,46g SiO2的物质的量为![]() ,含有共价键的物质的量为4×
,含有共价键的物质的量为4×![]() =
=![]() ,即含共价键数目为
,即含共价键数目为![]() NA,②错误;
NA,②错误;
③H218O和D2O的摩尔质量均为20g/mol,2g H218O和D2O的混合物的物质的量=![]() =0.1mol,每个H218O和D2O分子均含10个电子,故2g H218O和D2O的混合物所含电子的物质的量=0.1mol×10=1mol,即所含电子数为NA,③正确;
=0.1mol,每个H218O和D2O分子均含10个电子,故2g H218O和D2O的混合物所含电子的物质的量=0.1mol×10=1mol,即所含电子数为NA,③正确;
④K2SO4中K+和SO42-之间以离子键结合,溶于水电离出K+和SO42-,离子键断裂,无共价键断裂,④错误;
⑤Na2O2由Na+和O22-构成,78g Na2O2的物质的量为![]() =1mol,所以78g Na2O2中所含离子的物质的量=1mol×3=3mol,即含离子数目为3NA,⑤错误;
=1mol,所以78g Na2O2中所含离子的物质的量=1mol×3=3mol,即含离子数目为3NA,⑤错误;
⑥18g D2O的物质的量为![]() ,每个D2O分子的中子数=1×2+8×1=10,故18g D2O所含中子的物质的量为0.9mol×10=9mol,即中子数为9NA,小于10NA,⑥正确;
,每个D2O分子的中子数=1×2+8×1=10,故18g D2O所含中子的物质的量为0.9mol×10=9mol,即中子数为9NA,小于10NA,⑥正确;
⑦若1mol NH5中含有5NA个N—H键,则1和NH5分子中含5个N-H键,N原子最外层电子数为10,与NH5中所有原子都达到稀有气体的稳定结构矛盾,⑦错误;
综上所述,①②④⑤⑦错误,C满足题意。答案选C。

【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
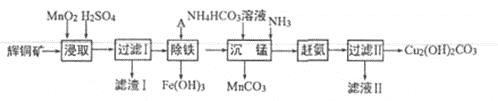
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。