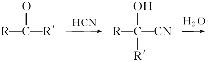
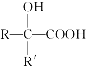
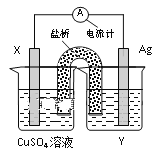
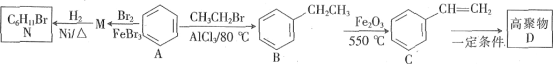
��Ŀ����
����Ŀ��Fe��Co��Ni��Ϊ�ڢ���Ԫ�أ����ǵĻ����������������������Ź㷺��Ӧ�á�
��1����̬Coԭ�ӵļ۵����Ų�ʽΪ_______��Co2������3d�ܼ�����_____�ԳɶԵ��ӡ�
��2��Co3����һ��������[Co(N3)(NH3)5]2���У�Co3������λ����________��1 mol��������������������ĿΪ________����λ��N3-����ԭ�ӵ��ӻ�����Ϊ________��
��3��Co2����ˮ��Һ����[Co(H2O)6]2�����ڡ���Co2������Һ�м��������ˮ�����ɸ��ȶ���[Co(NH3)6]2������ԭ����_________________________________________________��
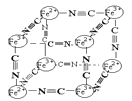
��4��ij��ɫ���徧��ṹ��ͼ��Fe2����Fe3���ֱ�ռ�������廥�����ڵĶ��㣬���������ÿ�����Ͼ���һ��CN����K��λ��������������ϡ��ݴ˿�֪�þ���Ļ�ѧʽΪ________����������Fe2�������������γɵĿռ乹����________��K����ȱ�ʣ�������û��K����ռ�����ĵİٷֱȣ�Ϊ_____________��
��5��NiO�ľ����ṹ��ͼ����ʾ������ԭ���������AΪ(0,0,0)��BΪ(1,1,0)����Cԭ���������Ϊ________��
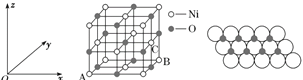
ͼ�� ͼ��
��6��һ���¶��£�NiO��������Է��ط�ɢ���γ��������Ӳ�����������ΪO2�������õ������У�Ni2���������(��ͼ��)����֪O2���İ뾶Ϊa pm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ________g(�ú�a��NA�Ĵ���ʽ��ʾ)��
���𰸡�3d74s2 2 6 23NA sp NԪ�ص縺�Ա�OԪ�ص縺��С��Nԭ���ṩ�µ��ӶԵ����������Co2���γɵ���λ����ǿ KFe2(CN)6 ���������� 50% (1��![]() ��
��![]() )
) ![]()
��������
��1��COԭ�ӵĺ˵����Ϊ27����̬CO�ļ۵����Ų�ʽΪ3d74s2��Co2+��������Ų�Ϊ3d7��3d�ܼ�����2�ԳɶԵ��ӣ�
��2���������Ӻ�N3-�е�ԭ�����йµ��Ӷԣ��ܹ���Co+�γ���λ��������5�������Ӻ�1��N3-���ӣ���Co+�γɵĵ���λ��Ϊ6������5 mol���������ṩ����Ϊ15mol��1 mol N3-�к�������2 mol���γ���λ����6 mol������1mol ��������������������ĿΪ23NA���ӻ������=����ԭ�ӵŵ��Ӷ���+����ԭ�ӵ���������Ŀ������N3-���ĵ�ԭ�ӹµ��Ӷ���Ϊ0����������ĿΪ2�������ӻ������Ϊ2������sp�ӻ���
��3��Co2+��ˮ��Һ����[Co(H2O)6]2+���ڡ���Co2+����Һ�м��������ˮ�����ɸ��ȶ���[Co(NH3)6]2+ ����ԭ����NԪ�ص縺�Ա�OԪ�ص縺��С��Nԭ���ṩ�µ��ӶԵ����������Co2+�γɵ���λ����ǿ��
��4��Fe2+��Fe3+ռ��������Ļ������ڵĶ��㣬��ÿ������������4��Fe2+��4��Fe3+�����ݾ���Ŀռ�ṹ�ص㣬ÿ�������ϵ�������1/8���ڸ������壬�������������1/2��Fe2+��1/2��Fe3+��CN-λ������������ϣ����ϵ�����1/4���ڸ������壬������������3��CN-�����Ըþ���Ļ�ѧʽΪ [FeFe(CN)6]-���������ʳʵ����ԣ�������Ҫһ����������֮��ϣ����Ըþ���Ļ�ѧʽΪKFe2(CN)6����������Fe2+�����������γɵĿռ乹�������������Σ�
��5����NiO�����������������AΪ��0��0��0����BΪ��1��1��0��������ͼ�ɿ���C����������xΪ1����yΪ![]() ����zΪ
����zΪ![]() �����������Ϊ��1��
�������������1��![]() ��
��![]() ����
����
��6�����ݽṹ֪�������Ӻ����ڵ�������֮��ľ���Ϊ2a��������������������Ӻ˼�ľ����Ǿ�������������Ӻ������Ӿ����![]() ���������������2
���������������2![]() am������ͼƬ֪��ÿ����������ռ�����=2a m��2a m��sin60���10-24����ÿƽ�����е�����������=1/(2a m��2a m��sin60���10-24)=
am������ͼƬ֪��ÿ����������ռ�����=2a m��2a m��sin60���10-24����ÿƽ�����е�����������=1/(2a m��2a m��sin60���10-24)=![]() ��1024��ÿ��������������=
��1024��ÿ��������������=![]() g������ÿƽ�����е�����������=
g������ÿƽ�����е�����������=![]() ��
��![]() ��1024=
��1024=![]() ��
��

 �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�