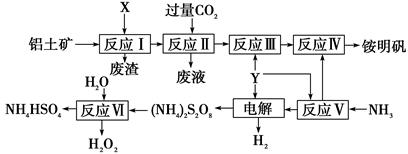
题目内容
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。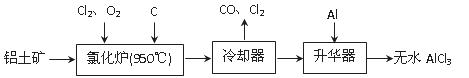
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
(1)Al2O3+3Cl2+3C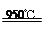 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2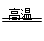 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)
解析试题分析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2――SO42-+2Cl-,再根据电荷守恒有SO32-+Cl2――SO42-+2Cl-+2H+,最后根据原子守恒得SO32-+Cl2+H2O=SO42-+2Cl-+2H+。
⑶由于升华器中含有AlCl3和FeCl3(杂质),加入少量Al,可与FeCl3反应将其除去。
⑷在含有FeCl3杂质的AlCl3产品中加入过量的NaOH溶液所发生的离子方程式有①Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O;沉淀物[Fe(OH)3]经洗涤、灼烧、冷却、称重,残留固体(Fe2O3)质量为0.32 g,据原子守恒可计算AlCl3产品的纯度: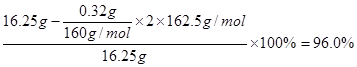 。
。
⑸为了抑制AlCl3的水解,必须在在HCl气流中加热AlCl3·6H2O,使其脱结晶水(否则会生成Al(OH)3或Al2O3)。
⑹据题意该反应的生成物有Fe3C、O2(空气),生成物有Fe3O4(磁性的固体)、CO2,根据氧化还原反应的配平方法将其配平,并标出反应条件(高温)。
考点:本题考查氧化还原反应方程式和离子方程式的书写、盐类的水解、根据化学反应方程式的化学计算(原子守恒)等。

在某无色透明的酸性溶液中,能大量共存的离子组是
| A.Na+ 、K+、SO42-、HCO3- | B.Na十、Ba2+、NO3-、SO42- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、OH- |
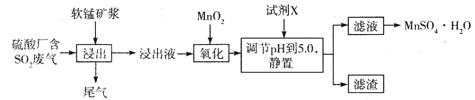
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。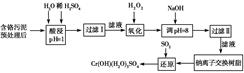
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:

 ;
;生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。


 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、 、
、 、
、 ,已知:
,已知: