题目内容
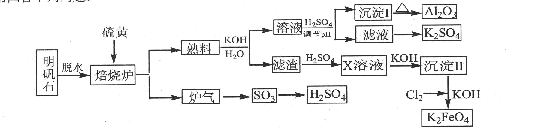
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
(1)SO2+MnO2=MnSO4 (2)2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)pH计, 4.7 ≤pH<8.3 (4)吸附时间、金属离子的半径 、金属离子的电荷;Pb2+、Ca2+
(5)1.82×10 - 3
解析试题分析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3。因此应调节pH的范围为4.7 ≤pH<8.3。(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;吸附步骤除去的主要离子为Pb2+、Ca2+。(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol/LCaCl2溶液与2.00×10—2 mol/LNa2SO4溶液等体积混合,由于忽略体积的变化,所以混合后氯化钙和硫酸钠溶液的浓度都要减半;c(SO42-)=1.00×10—2 mol/L. c(Ca2+)=c/2mol/L.由于Ksp(CaSO4)= 9.10×10—6,c(SO42-)·c(Ca2+)≥9.10×10—6,则生成沉淀时c(Ca2+)≥(9.10×10—6÷1.00×10—2 mol/L)×2=1.82×10-3mol/L。因此c的最小值是1.82×10-3mol/L.
考点:考查化学反应原理、影响离子吸收的因素及沉淀溶解平衡和溶度积的计算的知识。

常温,相应条件下,下列各组离子一定能大量共存的是
| A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH- |
| B.无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
C.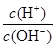 =1×1014的溶液:Ba2+、Na+、SO32-、NO3- =1×1014的溶液:Ba2+、Na+、SO32-、NO3- |
| D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl- |
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为 。
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 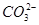 、 、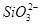 、 、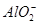 、Cl- 、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、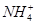 、Na+ 、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
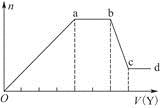
①若Y是盐酸,则溶液中含有的金属阳离子是____________________________,
ab段发生反应的总离子方程式为______________________________________,
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为
_________________________________________________________________。
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为____________________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO
 Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:
___________________________________,________________________________。
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .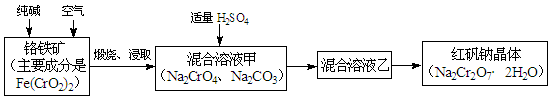
 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。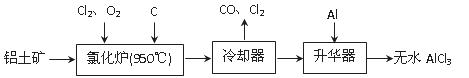
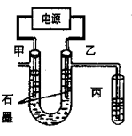
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: