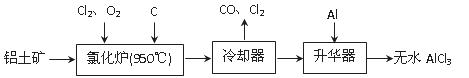
题目内容
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下: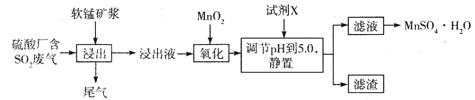
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
(1)部分SO2与水结合生成H2SO3,H2SO3电离出H+使pH<2(2分)
(2)MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
(3)能(1分) Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质(2分)
(4)Fe(OH)3、Al(OH)3(1分) 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红(2分)
(5)蒸发浓缩、冷却结晶、过滤(2分)
解析试题分析:
(1)部分SO2与水结合生成H2SO3,H2SO3电离出H+使pH<2
(2)MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O; 得到的产品中含有FeSO4杂质
Mn2++2Fe3++2H2O; 得到的产品中含有FeSO4杂质
(3)能; Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质
(4)Fe(OH)3、Al(OH)3; 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红;
(5)蒸发浓缩、冷却结晶、过滤
考点:考查硫酸锰的工艺流程。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案下列实验现象及相关的离子方程式均正确的是( )
| A.碳酸钙粉末中加入醋酸溶液,固体质量减小,生成无色气体 CaCO3 + 2H+=Ca2+ + CO2↑ + H2O |
| B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色 2MnO4- + 7H2O2 + 6H+ = 2Mn2+ + 6O2↑ + 10H2O |
| D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀 |
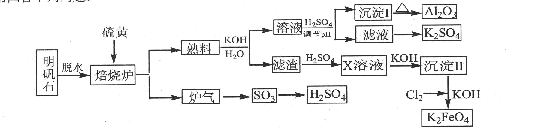
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下: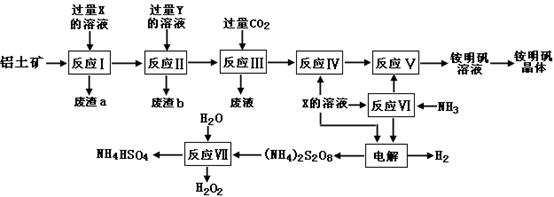
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
下列叙述I和II均正确并有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示。
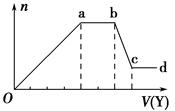
(1)若Y是盐酸,则Oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,
ab段发生反应的离子是 ,bc段发生反应的离子方程式为 。
(2)若Y是NaOH溶液,则X中一定含有的离子是 ,ab段反应的离子方程式为 。
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .