题目内容
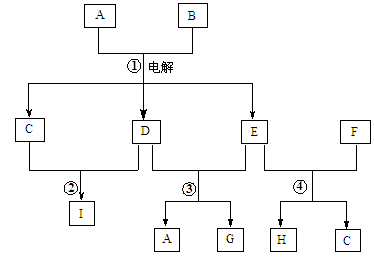
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。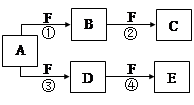
回答下列问题:
(1)A的电子式为 。
(2)A和E反应生成G,C与G中都含有 (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为 mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式: 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为: 。
(1) (2分) (2) 共价键(或极性共价键)(2分)(3)0.5(2分)
(2分) (2) 共价键(或极性共价键)(2分)(3)0.5(2分)
(4)2NH3—6e-+6 OH-=N2+6H2O (2分) (5)c(Na+) >c(SO42-) >c(NH4+)>c(H+) = c(OH-)
解析试题分析:根据题意知,X、Y、Z是三种短周期元素,Z的电子层数是X的电子层数的2倍,则X位于第一周期, Z位于第二周期;A是能使湿润红色石蕊试纸变蓝的气体,A为氨气;则X为氢元素,Y和Z中有一种为氮元素,X和Z的质子数之和与Y的质子数相等,若Z为氮元素,则Y为氧元素,若Y为氮元素,则Z为碳元素,结合题给信息及转化关系知,Z为氮元素,Y为氧元素;F为氧气,B为一氧化氮,C为二氧化氮,D为亚硝酸,E为硝酸;(1)A为氨气,电子式为 ;(2)氨气和硝酸反应生成硝酸铵,硝酸铵和二氧化氮均含有的化学键为共价键(或极性共价键);(3)反应③为氨气氧化为亚硝酸,氮元素的化合价由—3价升高到+3价,1mol氨气被氧化转移6mol电子,如果转移的电子为3 mol,则被氧化的A为0.5mol;(4)本题考查氨气燃料电池,根据原电池原理知,氨气发生氧化反应,在负极发生反应,结合题给信息和原子守恒、电荷守恒知,负极反应式为2NH3—6e-+6 OH-=N2+6H2O;(5)由题意知,盐A为NH4HSO4,与氢氧化钠反应至中性,混合液中溶质为硫酸钠、硫酸铵和一水合氨,离子浓度由大到小的顺序为:c(Na+) >c(SO42-) >c(NH4+)>c(H+) = c(OH-)。
;(2)氨气和硝酸反应生成硝酸铵,硝酸铵和二氧化氮均含有的化学键为共价键(或极性共价键);(3)反应③为氨气氧化为亚硝酸,氮元素的化合价由—3价升高到+3价,1mol氨气被氧化转移6mol电子,如果转移的电子为3 mol,则被氧化的A为0.5mol;(4)本题考查氨气燃料电池,根据原电池原理知,氨气发生氧化反应,在负极发生反应,结合题给信息和原子守恒、电荷守恒知,负极反应式为2NH3—6e-+6 OH-=N2+6H2O;(5)由题意知,盐A为NH4HSO4,与氢氧化钠反应至中性,混合液中溶质为硫酸钠、硫酸铵和一水合氨,离子浓度由大到小的顺序为:c(Na+) >c(SO42-) >c(NH4+)>c(H+) = c(OH-)。
考点:考查元素推断、氧化还原反应、燃料电池及离子浓度大小比较。

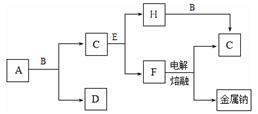
如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).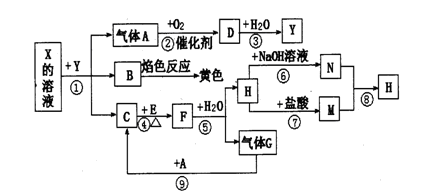
请回答下列问题:
(1)固体C的晶体类型是 ,F的化学式是 。
(2)工业上要实现A—D D—Y的转化需要的设备分别是 、 。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是 。
(4)反应⑧的离子方程式为 。
(5)正盐X中酸根离子中除氧元素外另一种元素的平均化合价可能为( )。
| A.+4价 | B.-2价 | C. 0价 | D.+2价 |