题目内容
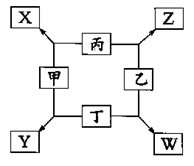
如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).
请回答下列问题:
(1)固体C的晶体类型是 ,F的化学式是 。
(2)工业上要实现A—D D—Y的转化需要的设备分别是 、 。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是 。
(4)反应⑧的离子方程式为 。
(5)正盐X中酸根离子中除氧元素外另一种元素的平均化合价可能为( )。
| A.+4价 | B.-2价 | C. 0价 | D.+2价 |
(1)分子晶体 Al2S3(2)接触室 吸收塔(3)1∶2(4)Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓(5)D(6)前者大
解析试题分析:根据框图及物质的性质,可推知:X是Na2S2O3;Y是H2SO4;A是SO2;B是Na2SO4;C是S;D是SO3;E是Al;F是Al2S3;G是H2S;H是Al(OH)3;M是AlCl3;N是NaAlO2.(1)固体C是硫单质。属于分子晶体。F的化学式是Al2S3。(2)工业上二氧化硫制取三氧化硫是在接触室中进行的。三氧化硫制取硫酸是在 吸收塔中完成的。(3)⑨中发生的反应是:2H2S+SO2=3S+H2O。SO2作氧化剂,H2S作还原剂。氧化剂与还原剂的物质的量之比是1:2.(4)反应⑧的离子方程式为:Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓(5)根据化合物中正负化合价的代数和为零。可得S元素的平均化合价为+2价。选项为 :D。(6)由2Al+6HCl=2AlCl3+3H2↑;2Al+2H2O+2NaOH=2NaAlO2+3H2↑.可知:分别向等体积等浓度的氢氧化钠溶液和盐酸中小心加入足量的E,同温同压下产生气体体积的大小关系是前者大 。
考点:考查元素的推断、硫酸的工业制法及铝、氢氧化铝等物质性质的知识。

常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| | X | Y | Z |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |