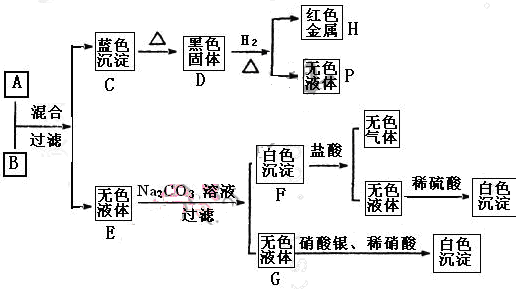
题目内容
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物。反应②、④是工业上的重要反应,部分物质及反应条件没有列出。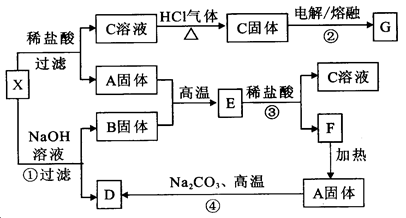
请回答下列问题:
(1)写出A、E、B的化学式:A________, E___________,B___________。
(2)写出C溶液转化为C固体的过程中,HCl气流的作用:________________________。
(3)写出①、③、④反应的化学方程式,(若是离子反应写离子方程式)
①__________________________________________________;
③__________________________________________________;
④__________________________________________________。
(4)将SO2气体分别通入下列溶液写出对应的实验现象
①BaCl2溶液________________________________;
②Ba(NO3)2溶液_____________________________________;
⑨FeCl3溶液_____________________________。
(共10分)(1)SiO2 MgSiO3 MgO (每空1分)(2)抑制氯化镁水解(1分)
(3) ①SiO2 + 2 OH―=SiO32- + H2O (1分) ③MgSiO3 + 2H+=H2SiO3↓+ Mg2+(1分)
④SiO2 + Na2CO3 Na2SiO3 + CO2↑(1分) (4)① 无明显现象 (1分)
Na2SiO3 + CO2↑(1分) (4)① 无明显现象 (1分)
② 产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色(1分)
③ 溶液由棕黄色变为浅绿色(1分)
解析试题分析:C溶液需要在氯化氢的气体中加热才能得到C固体,说明C是氯化物,且C中的金属阳离子在溶液中水解。又因为电解熔融的C可以得到G,所以C是氯化镁,G是氯气或金属镁。由于X为第三周期两种重要单质的氧化物的混合物,所以X中含有氧化镁。X能和氢氧化钠溶液反应生成B固体和D,则B应该是氧化镁。A固体在高温下能和碳酸钠反应生成D,因此根据反应②、④是工业上的重要反应可知,A固体应该是二氧化硅,D是硅酸钠。二氧化硅和氧化镁在高温下反应生成硅酸镁。硅酸镁和稀盐酸反应生成氯化镁和硅酸,即F是硅酸。硅酸分解生成二氧化硅和水。
(1)根据以上分析可知A、E、B的化学式分别是)SiO2、MgSiO3、MgO。
(2)镁离子在溶液中水解,所以氯化氢的作用是抑制氯化镁水解。
(3)根据以上分析可知①、③、④反应的方程式分别是①SiO2 + 2 OH―=SiO32- + H2O;
③MgSiO3 + 2H+=H2SiO3↓+ Mg2+;④SiO2 + Na2CO3 Na2SiO3 + CO2↑。
Na2SiO3 + CO2↑。
(4)①SO2溶于水,溶液显酸性,所以与氯化钡溶液不反应,因此无明显实验现象。
②O2溶于水,溶液显酸性,在酸性条件下NO3-具有氧化性,能把SO2氧化,所以实验现象是产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色。
③铁离子具有氧化性,SO2具有还原性,能把氯化铁溶液氧化生成硫酸,二铁离子被还原生成亚铁离子,所以实验现象是溶液由棕黄色变为浅绿色。
考点:考查无机框图题的判断、常见化学用语的书写等

可用下图所示装置制取(必要时可加热)、净化、收集的气体是 
| A.铜与稀硝酸反应制一氧化氮 |
| B.氯化铵与氢氧化钙固体反应制氨气 |
| C.锌和稀硫酸反应制氢气 |
| D.亚硫酸钠固体与硫酸反应制二氧化硫 |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| | X | Y | Z |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
下列实验现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | Al(OH)3不溶于氢氧化钡溶液 |
| C | 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 | 溶液先不显红色,加入氯水后变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |