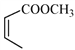
题目内容
【题目】下列反应的离子方程式不正确的是
A.苯酚与少量碳酸钠溶液的反应:![]() +CO32-→
+CO32-→![]() +HCO3-
+HCO3-
B.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH-
C.电解熔融氯化镁制镁:Mg2++2Cl-![]() Mg+Cl2↑
Mg+Cl2↑
D.铜与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
【答案】D
【解析】
A、因为苯酚的酸性比碳酸的弱,但是比HCO3-强,所以苯酚与少量碳酸钠溶液的反应为![]() +CO32-→
+CO32-→![]() +HCO3-,故A正确;
+HCO3-,故A正确;
B、I-具有还原性,空气中的氧气具有氧化性,相互之间发生氧化还原反应,故B正确;
C、K、Ca、Na、Mg、Al单质的还原性很强,所以制取K、Ca、Na、Mg、Al单质时除Al之外采用电解熔融盐的方式,故C正确;
D、硝酸是强电解质,铜与浓硝酸反应的离子反应方程式中,应该拆开,故D错误;
故选D;

【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
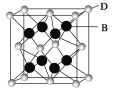
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。