题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
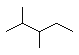
A.2.0g H2O与![]() 的混合物中所含质子数为NA
的混合物中所含质子数为NA
B.46g NO2 和N2O4 混合气体中含有的原子数为 3NA
C.1L 0.1 molL-1 氨水中含有 0.1NA NH3 分子
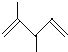
D.![]() 与
与![]() 充分反应,转移电子数为3NA
充分反应,转移电子数为3NA
【答案】B
【解析】
A.一个H2O分子中含有的中子数=8+0=8,一个D2O分子中含有中子数=8+2=10,2.0g D2O的物质的量![]() =0.1mol,含有中子数为0.1mol×10×NA=NA;2.0gH2O的物质的量为
=0.1mol,含有中子数为0.1mol×10×NA=NA;2.0gH2O的物质的量为![]() mol,含有中子数为
mol,含有中子数为![]() mol×8×NA=
mol×8×NA=![]() NA,则2.0g二者的混合物含有的中子数小于NA,故A错误;
NA,则2.0g二者的混合物含有的中子数小于NA,故A错误;
B.NO2和N2O4的最简式为NO2,46g NO2 和N2O4 混合气体最简式的物质的量为![]() =1mol,一个NO2中含有3个原子,则1mol混合气体中含有的原子数为1mol×3×NA =3NA,故B正确;
=1mol,一个NO2中含有3个原子,则1mol混合气体中含有的原子数为1mol×3×NA =3NA,故B正确;
C.1L 0.1 molL-1 氨水的物质的量为1mol,则氮元素的物质的量为0.1mol,根据氮元素守恒,氨水中氮元素以铵根离子、一水合氨分子、氨气分子形式存在,三者氮元素的总量为0.1mol,则其中含有 NH3分子的数量小于0.1NA,故C错误;
D.铁与氯气反应的方程式为2Fe+3Cl2![]() 2FeCl3,
2FeCl3,![]() 与
与![]() 充分反应,铁过量,用氯气计算,3mol氯气参与反应转移6mol电子,则1mol氯气完全反应转移2mol电子,个数为2NA,故D错误;
充分反应,铁过量,用氯气计算,3mol氯气参与反应转移6mol电子,则1mol氯气完全反应转移2mol电子,个数为2NA,故D错误;
答案选B。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目