题目内容
【题目】将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如图的原电池,则下列说法一定错误的是( )
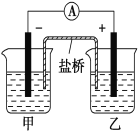
A. Cd作负极,Co作正极
B. 原电池工作时,电子从负极沿导线流向正极
C. 甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
【答案】D
【解析】
A.反应 Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)(aq表示溶液)中钴得到电子发生还原反应,则钴为正极,Cd作负极,故正确;B. 原电池工作时,电子从负极沿导线流向正极,故正确;C. 甲池中镉失去电子发生氧化反应,电解质溶液为CdCl2溶液,乙池中盛放的是CoCl2溶液,故正确;D. 盐桥中装有含氯化钾的琼脂,阳离子向正极移动,阴极向负极移动,实现闭合回路,电子不能从盐桥通过,故D错误。故选D。

练习册系列答案
相关题目