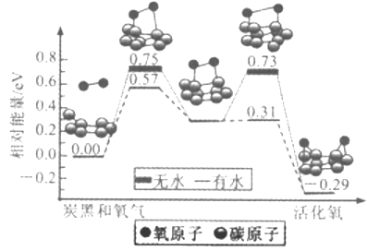
题目内容
【题目】如图所示,烧杯内盛有浓 HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb 都有剩余.下列说法正确的是( )
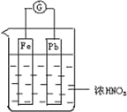
A. Fe比Pb活泼,始终作负极
B. Fe在浓硝酸中钝化,始终不会溶解
C. 电池停止工作时,烧杯中生成了硝酸铁
D. 利用浓硝酸做电解质溶液不符合“绿色化学”思想
【答案】D
【解析】
A. Fe 比 Pb 活泼,铁在浓硝酸中钝化,所以开始铁做负极,钝化后,铅做负极,故错误;B. Fe 在浓硝酸中钝化,铁反应生成致密的氧化物,但当溶液为稀硝酸时,铁做负极,会溶解,故错误;C. 铁做负极生成亚铁离子,所以电池停止工作时,烧杯中生成了硝酸亚铁,故错误;D. 利用浓硝酸做电解质溶液会产生二氧化氮,不符合“绿色化学”思想,故正确。故选D。

 名校课堂系列答案
名校课堂系列答案【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。
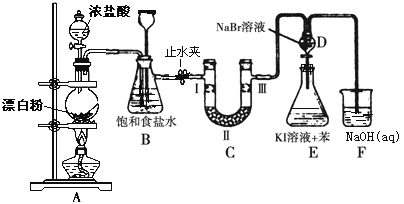
(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。