题目内容
6.由两种气态烃组成的混合气体,其所含碳元素和氢元素的质量之比为 24:3,则混合气体的组成及其体积比可能是( )| A. | CH4和 C3H4,体积比为 1:1 | B. | C2H2和 C2H6,体积比为 3:1 | ||
| C. | C2H4和C2H6,体积比为 2:1 | D. | C2H2和 C2H4,体积比为 2:3 |
分析 由两种气态烃组成的混合气体,其所含的碳元素和氢元素的质量之比为24:3,则混合气体中C、H原子数目之比=$\frac{24}{12}$:$\frac{3}{1}$=2:3,据此结合选项确定可能组成,根据组成中C原子或H原子数目计算体积之比,据此解答.
解答 解:由两种气态烃组成的混合气体,其所含的碳元素和氢元素的质量之比为24:3,则混合气体中C、H原子数目之比=$\frac{24}{12}$:$\frac{3}{1}$=2:3,
A.CH4和C3H4的平均C、H原子数目之比可能为2:3,令CH4和C3H4的物质的量分别为x mol、ymol,则:$\frac{x+3y}{x+y}$:4=2:3,解得x:y=1:5,故A不符合;
B.C2H2和C2H6的平均C、H原子数目之比可能为2:3,令C2H2和C2H6的物质的量分别为x mol、ymol,由H原子平均可知:$\frac{2x+6y}{x+y}$=3,解得x:y=3:1,故B符合;
C.C2H4和C2H6的平均C、H原子数目之比不可能为2:3,故C不符合;
D.C2H2和C2H4的平均C、H原子数目之比可能为2:3,令C2H2和C2H4的物质的量分别为x mol、ymol,由H原子平均可知:$\frac{2x+4y}{x+y}$=3,解得x:y=1:1,故D符合;
故选B.
点评 本题考查混合物的计算,题目难度不大,注意利用平均值法解答该题.

练习册系列答案
相关题目
14.已知N≡N键的键能是a kJ﹒mol-1,H-H键的键能是b kJ﹒mol-1,N-H键的键能是c kJ﹒mol-1,则N2(g)+3H2(g)=2NH3(g)的△H(单位:kJ﹒mol-1)为( )
| A. | 3c-a-b | B. | a+b-3c | C. | a+3b-2c | D. | a+3b-6c |
1.下列说法正确的是( )
| A. | 石油常压分馏后可得到汽油、煤油等轻质油,以及润滑油、石蜡等 | |
| B. | 在制备环氧乙烷时发生下列反应 CH2=CH2+Cl2+Ca(OH)2→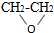 +CaCl2+H2O,此反应原子利用率达到了 100%° +CaCl2+H2O,此反应原子利用率达到了 100%° | |
| C. | 煤的干馏、煤的气化和液化能够实现煤的综合利用,且这三个变化都属于化学变化 | |
| D. | 含氮、磷的大量污水任意排放,会造成白色污染 |
11.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予在“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家.下列分子中不含有“手性碳原子”的是( )
| A. | 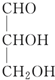 | B. | 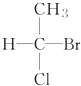 | C. | CH3CH2OH | D. | 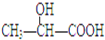 |
18.下列溶液中微粒浓度关系一定正确的是( )
| A. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| B. | 0.1 mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 室温下,氢氧化钠与氯化铵的混合溶液的pH=7,则有c(Cl-)=c(NH4+)+c(Na+) |
15.用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),则( )
| A. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=0.2mol/L |
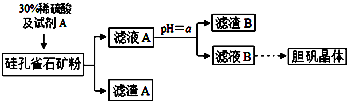
1.硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如下:
部分氢氧化物开始沉淀和完全沉淀的pH如下表
请回答下列问题:
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.

部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
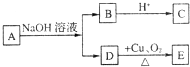 某有机物A的化学式为C5H10O2,己知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均不能发生银镜反应,则A的结构可能有( )
某有机物A的化学式为C5H10O2,己知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均不能发生银镜反应,则A的结构可能有( )