题目内容
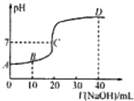 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 0.1000mol/L的CH3COOH.滴定曲线如图所示.下列分析错误的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 0.1000mol/L的CH3COOH.滴定曲线如图所示.下列分析错误的是( )| A、C点的溶液:c(CH3COO-)+c(CH3COOH)>c(Na-) |
| B、B点的溶液:c(CH3COO-)>(Na+)>c(H-)>c(OH-) |
| C、A点的纵坐标值为1 |
| D、D点溶液2c(CH3COOH)+c(H+)=c(OH-)-c(CH3COO-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.C点时溶液显示中性,则c(H-)=c(OH-),根据电荷守恒可得c(CH3COO-)=c(Na-),由于溶液中存在醋酸分子,则c(CH3COO-)+c(CH3COOH)>c(Na-);
B.B点时溶质为等浓度的醋酸和醋酸钠,由于醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>(Na+),溶液显示酸性,则c(H-)>c(OH-);
C.醋酸为弱电解质,溶液中只能部分电离出氢离子,则0.1000mol/L的CH3COOH溶液的pH大于1;
D.在D点时,加入氢氧化钠的物质的量为醋酸的2倍,根据溶液中物料守恒、电荷守恒进行判断各离子浓度关系.
B.B点时溶质为等浓度的醋酸和醋酸钠,由于醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>(Na+),溶液显示酸性,则c(H-)>c(OH-);
C.醋酸为弱电解质,溶液中只能部分电离出氢离子,则0.1000mol/L的CH3COOH溶液的pH大于1;
D.在D点时,加入氢氧化钠的物质的量为醋酸的2倍,根据溶液中物料守恒、电荷守恒进行判断各离子浓度关系.
解答:
解:A.在C点时溶液的pH=7,溶液显示中性,则c(H-)=c(OH-),根据电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+)可得c(CH3COO-)=c(Na-),由于溶液中存在醋酸分子,则c(CH3COO-)+c(CH3COOH)>c(Na-),故A正确;
B.在B点所示溶液中,为等量的醋酸和醋酸钠溶液,醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>(Na+),溶液显示酸性,则c(H-)>c(OH-),溶液中离子浓度大小为:c(CH3COO-)>(Na+)>c(H-)>c(OH-),故B正确;
C.0.1000mol/L的CH3COOH溶液中,醋酸电离出的氢离子浓度一定小于0.1mol/L,则溶液的pH大于1,故C错误;
D.在D点时加入40mL的氢氧化钠溶液,则此时氢氧化钠的总物质的量为醋酸的2倍,根据物料守恒可得:c(Na+)=2(CH3COO-)+2(CH3COOH),根据电荷守恒可得:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),将钠离子浓度带入电荷守恒:2c(CH3COOH)+c(H+)=c(OH-)-c(CH3COO-),故D正确;故选C.
B.在B点所示溶液中,为等量的醋酸和醋酸钠溶液,醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>(Na+),溶液显示酸性,则c(H-)>c(OH-),溶液中离子浓度大小为:c(CH3COO-)>(Na+)>c(H-)>c(OH-),故B正确;
C.0.1000mol/L的CH3COOH溶液中,醋酸电离出的氢离子浓度一定小于0.1mol/L,则溶液的pH大于1,故C错误;
D.在D点时加入40mL的氢氧化钠溶液,则此时氢氧化钠的总物质的量为醋酸的2倍,根据物料守恒可得:c(Na+)=2(CH3COO-)+2(CH3COOH),根据电荷守恒可得:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),将钠离子浓度带入电荷守恒:2c(CH3COOH)+c(H+)=c(OH-)-c(CH3COO-),故D正确;故选C.
点评:本题考查酸碱混合的定性判断、溶液中离子浓度大小比较的方法,明确混合后溶液中的溶质是解答的关键,注意电荷守恒和物料守恒的应用,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于锂的结构和性质的判断:①与水反应比钠剧烈;②锂的原子半径比钠小;③锂的氧化物暴露于空气中易吸收CO2;④锂的阳离子的最外层电子数和钠离子的最外层电子数相同;⑤锂是还原剂.其中错误的是( )
| A、只有①和⑤ |
| B、只有②和③ |
| C、只有③和⑤ |
| D、只有①和④ |
某合作学习小组讨论辨析以下说法正确的是( )
①粗盐和酸雨都是混合物
②硅是光导纤维的主要成分,SiO2可用于太阳能电池
③向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
④不锈钢和目前流通的硬币都是合金
⑤氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰
⑥纯碱和熟石灰都是碱.
①粗盐和酸雨都是混合物
②硅是光导纤维的主要成分,SiO2可用于太阳能电池
③向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
④不锈钢和目前流通的硬币都是合金
⑤氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰
⑥纯碱和熟石灰都是碱.
| A、①③④ | B、①②③④⑥ |
| C、③④⑤⑥ | D、①②④⑤ |
常温下,Na2CO3溶液中存在平衡:CO32-+H2O?HCO3-+OH-,下列有关该溶液的说法正确的是( )
| A、离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| B、升高温度,平衡向右移动 |
| C、滴入CaCl2浓溶液,溶液的pH增大 |
| D、加入NaOH固体,溶液的pH减小 |
标准状况下H2和Cl2组成的混合气体a mol,其中氯气的体积分数为w.经光照后缓缓通入含b mol NaOH的溶液中充分反应,测得最终溶液中含有c mol NaClO(c>0),则下列说法正确的是( )
A、若c>b-a,则w=1-
| ||
B、若a+c>b,则w=1-
| ||
| C、若b=a+c,则w=0.5 | ||
D、若a<b-c,则w=
|
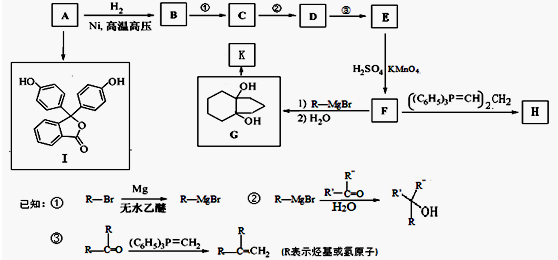
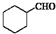 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
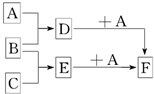 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E.它们之间转化关系如图所示.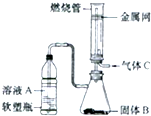 实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )
实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )