题目内容
标准状况下H2和Cl2组成的混合气体a mol,其中氯气的体积分数为w.经光照后缓缓通入含b mol NaOH的溶液中充分反应,测得最终溶液中含有c mol NaClO(c>0),则下列说法正确的是( )
A、若c>b-a,则w=1-
| ||
B、若a+c>b,则w=1-
| ||
| C、若b=a+c,则w=0.5 | ||
D、若a<b-c,则w=
|
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:最终溶液中含有c mol NaClO,说明氢气与氯气反应后氯气有剩余,则光照后气体是HCl、Cl2的混合物,由H2+Cl2=2HCl可知,H2、Cl2物质的量总共为amol,再通入NaOH溶液,发生反应:HCl+NaOH=NaCl+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,
若HCl、Cl2完全反应,可知n(NaCl)+n(NaClO)=(a+c)mol,根据钠离子守恒,需要氢氧化钠为(a+c)mol,
①a+c=b时,NaOH与HCl、Cl2恰好完全反应,得到NaCl、NaClO,根据钠原子守恒计算氯化钠和次氯酸钠的物质的量,根据氯原子计算氯气的物质的量,据此计算w;
②若a+c<b时,NaOH有剩余,由Cl原子守恒,2 n(Cl2)=n(NaCl)+n(NaClO)=amol+cmol,据此计算w;
③a+c>b时,NaOH不足,根据次氯酸钠计算氯气反应消耗的NaOH=2cmol,与HCl反应的NaOH为(b-2c)mol,根据H原子守恒计算氢气的物质的量,则n(Cl2)=n(混合气体)-n(H2),最后计算氯气体积分数.
若HCl、Cl2完全反应,可知n(NaCl)+n(NaClO)=(a+c)mol,根据钠离子守恒,需要氢氧化钠为(a+c)mol,
①a+c=b时,NaOH与HCl、Cl2恰好完全反应,得到NaCl、NaClO,根据钠原子守恒计算氯化钠和次氯酸钠的物质的量,根据氯原子计算氯气的物质的量,据此计算w;
②若a+c<b时,NaOH有剩余,由Cl原子守恒,2 n(Cl2)=n(NaCl)+n(NaClO)=amol+cmol,据此计算w;
③a+c>b时,NaOH不足,根据次氯酸钠计算氯气反应消耗的NaOH=2cmol,与HCl反应的NaOH为(b-2c)mol,根据H原子守恒计算氢气的物质的量,则n(Cl2)=n(混合气体)-n(H2),最后计算氯气体积分数.
解答:
解:最终溶液中含有c mol NaClO,说明氢气与氯气反应后氯气有剩余,则光照后气体是HCl、Cl2的混合物,由H2+Cl2=2HCl可知,H2、Cl2物质的量总共为amol,再通入NaOH溶液,发生反应:HCl+NaOH=NaCl+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,
若HCl、Cl2完全反应,含有氯元素物质的物质的量=n(NaCl)+n(NaClO)=(a+c)mol,根据钠离子守恒,需要n(NaOH)=(a+c)mol,
①a+c=b时,NaOH与HCl、Cl2恰好完全反应,得到NaCl、NaClO,可知n(Cl)=n(Na),可知n(Cl)=n(Na)=bmol,则氯气的物质的量=0.5bmol,氯气的体积分数=
×100%;
②若a+c<b时,NaOH有剩余,由Cl原子守恒,2 n(Cl2)=n(NaCl)+n(NaClO)=(a+c)mol,氯气的体积分数=
×100%=
×100%=
;
③若a+c>b时,NaOH不足,根据Cl2+2NaOH=NaCl+NaClO+H2O得n(NaOH)=2cmol,根据钠原子守恒得与HCl反应的n(NaOH)=(b-2c)mol,根据H原子守恒得n(H2)=
n(HCl)=
mol,则n(Cl2)=n(混合气体)-n(H2)=[a-
]mol,w=
=1-
.
A.通过以上分析知,若c>b-a,则w=1-
,故A错误;
B.若a+c>b,则w=1-
,故B正确;
C.若b=a+c,且w=0.5,则氯气和氢气恰好反应生成HCl,没有氯气剩余,则溶液中不可能存在次氯酸钠,不符合题意,故C错误;
D.通过以上分析知,若a<b-c,则w=
,故D正确;
故选BD.
若HCl、Cl2完全反应,含有氯元素物质的物质的量=n(NaCl)+n(NaClO)=(a+c)mol,根据钠离子守恒,需要n(NaOH)=(a+c)mol,
①a+c=b时,NaOH与HCl、Cl2恰好完全反应,得到NaCl、NaClO,可知n(Cl)=n(Na),可知n(Cl)=n(Na)=bmol,则氯气的物质的量=0.5bmol,氯气的体积分数=
| 0.5bmol |
| amol |
②若a+c<b时,NaOH有剩余,由Cl原子守恒,2 n(Cl2)=n(NaCl)+n(NaClO)=(a+c)mol,氯气的体积分数=
| ||
| a |
| a+c |
| 2a |
| a+c |
| 2a |
③若a+c>b时,NaOH不足,根据Cl2+2NaOH=NaCl+NaClO+H2O得n(NaOH)=2cmol,根据钠原子守恒得与HCl反应的n(NaOH)=(b-2c)mol,根据H原子守恒得n(H2)=
| 1 |
| 2 |
| b-2c |
| 2 |
| b-2c |
| 2 |
| ||
| a |
| b-2c |
| 2a |
A.通过以上分析知,若c>b-a,则w=1-
| b-2c |
| 2a |
B.若a+c>b,则w=1-
| b-2c |
| 2a |
C.若b=a+c,且w=0.5,则氯气和氢气恰好反应生成HCl,没有氯气剩余,则溶液中不可能存在次氯酸钠,不符合题意,故C错误;
D.通过以上分析知,若a<b-c,则w=
| a+c |
| 2a |
故选BD.
点评:本题考查了混合物的计算,关键物质之间的反应及物质的性质结合原子守恒分析解答,注意:加入的NaOH可能完全反应也可能不完全反应,要分情况讨论,为易错点,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
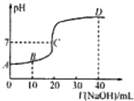 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 0.1000mol/L的CH3COOH.滴定曲线如图所示.下列分析错误的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 0.1000mol/L的CH3COOH.滴定曲线如图所示.下列分析错误的是( )| A、C点的溶液:c(CH3COO-)+c(CH3COOH)>c(Na-) |
| B、B点的溶液:c(CH3COO-)>(Na+)>c(H-)>c(OH-) |
| C、A点的纵坐标值为1 |
| D、D点溶液2c(CH3COOH)+c(H+)=c(OH-)-c(CH3COO-) |
下列实验现象所对应的离子方程式不正确的是( )
| A、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3 |
| B、向Ba(OH)2溶液中加入稀H2SO4恰好完全反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、向稀NaOH溶液氯水中加入:Cl2+2OH-═Cl-+ClO-+H2O |
| D、向FeCl2溶液中加入少量K3[Fe(CN)3]溶液:3Fe2++2[Fe(CN)3]3-═Fe3[Fe(CN)2]2↓ |
下列比较正确的是( )
| A、电负性:As>S>P |
| B、第一电离能F>N>O |
| C、熔点.BN>CCl4>MgBr2 |
| D、溶解性:乙醛>苯酚>乙醇 |
下列关于有机物的叙述正确的是( )
| A、汽油、柴油和植物油的成分都是碳氢化合物 |
| B、棉花和合成纤维的主要成分均为纤维素 |
| C、乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气 |
| D、甲烷跟氯气在光照条件下的反应与乙酸、乙醇和浓硫酸共热时的反应类型相同 |
下列说法正确的是( )
| A、石油分馏和煤的干馏都是物理变化 |
| B、塑料和蚕丝都是天然高分子化合物 |
| C、淀粉和纤维素水解的最终产物都是葡萄糖 |
| D、易溶于汽油、酒精、苯的物质一定是有机物 |
下列选项中的离子方程式书写正确的是( )
| A、稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、铜在加热条件下与浓硫酸反应:Cu+SO42-+4H+═Cu2++SO2↑+2H2O |
| D、SO2使溴水褪色:SO2+Br2+2H2O═SO42-+2Br-+4H+ |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍也是Y原子最外层电子数的3倍.下列说法正确的是( )
| A、Y与Z形成的简单离子核外电子排布相同 |
| B、X的氧化物为离子化合物 |
| C、Z的氢化物的水溶液在空气中容易变质 |
| D、X与Z对应的氧化物的水化物一定为强酸 |
下列物质作用时,反应条件或反应物用量的改变,所得的产物的成分不会发生改变的是( )
| A、固体Na2O2与CO2 |
| B、氯气与NaOH溶液 |
| C、Ba(OH)2溶液与SO2 |
| D、饱和NaHCO3溶液与石灰水 |